题目内容
【题目】已知![]() 为中学化学中一种常见的盐,
为中学化学中一种常见的盐,![]() 为淡黄色固体;
为淡黄色固体;![]() 、
、![]() 为常见的金属,
为常见的金属,![]() 的氧化物可作耐火材料,可用它来制造耐火坩埚和耐高温试验仪器;
的氧化物可作耐火材料,可用它来制造耐火坩埚和耐高温试验仪器;![]() 为气体单质,
为气体单质,![]() 为无色气体,
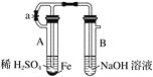
为无色气体,![]() 在空气中会出现红棕色,各物质的转化关系如下图(部分反应产物已略去)。
在空气中会出现红棕色,各物质的转化关系如下图(部分反应产物已略去)。

请回答下列问题;
(1)![]() 氧化物的化学式为__________,
氧化物的化学式为__________,![]() 的电子式为_________。
的电子式为_________。
(2)反应③的化学方程式为_________________。
(3)在反应①②③④中不属于置换反应的是________________(填序号)。
(4)写出![]() 与
与![]() 以等物质的量进行反应的离子方程式________________。
以等物质的量进行反应的离子方程式________________。
(5)![]() 和
和![]() 的混合溶液,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到
的混合溶液,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到![]() 气体(标准状况下),假定电解后溶液体积仍为
气体(标准状况下),假定电解后溶液体积仍为![]() 。
。
①写出电解时阳极的电极反应式____________________;
②电解后溶液中![]() 为____________________
为____________________![]()
【答案】Al2O3 ![]() 2Al+Fe2O3
2Al+Fe2O3![]() 2Fe+Al2O3 ②④ 2Cu2++2Na2O2+2H2O = 2 Cu(OH)2+O2 ↑ + 4Na+ 4OH-— 4e-=O2↑ +2H2O 或 2H2O — 4e-=O2↑ +4 H+ 0.4
2Fe+Al2O3 ②④ 2Cu2++2Na2O2+2H2O = 2 Cu(OH)2+O2 ↑ + 4Na+ 4OH-— 4e-=O2↑ +2H2O 或 2H2O — 4e-=O2↑ +4 H+ 0.4
【解析】
已知X为中学化学中一种常见的盐,F为淡黄色固体,两者反应生成蓝色沉淀,可以推出F为Na2O2,而X为铜盐;D为无色气体,D在空气中会出现红棕色,可以推出D为NO气体,结合M、N为常见的金属,N的氧化物可作耐火材料,可用它来制造耐火坩埚和耐高温试验仪器,可以推出N为Mg或者Al ,再结合固体E与N的反应,可以推出E为Fe2O3,该反应为熟悉的铝热反应,综上所述,A为硝酸亚铁,B为氯化铁,C为铜,D为一氧化氮,E为氧化铁,F为过氧化钠,G为氢氧化铁,H为氧气,M为铁,N为铝,X为硝酸铜,Y为氢氧化铜。
(1)N为铝,其氧化物为氧化铝,化学式为![]() ,F为过氧化钠,其电子式为
,F为过氧化钠,其电子式为![]() ,故答案为:
,故答案为:![]() ;
;![]() ;
;
(2)反应③是铝和氧化铁发生铝热反应,方程式为:2Al+Fe2O3![]() 2Fe+Al2O3,故答案为:2Al+Fe2O3
2Fe+Al2O3,故答案为:2Al+Fe2O3![]() 2Fe+Al2O3;
2Fe+Al2O3;
(3)①是铁和硝酸铜反应,属于置换反应,②是硝酸亚铁和盐酸反应,不是置换反应,③是铝和氧化铁发生铝热反应,属于置换反应,④是氯化铁和过氧化钠反应,反应物中没有单质,不是置换反应,故答案为:②④;
(4)X为硝酸铜,F为过氧化钠,二者等物质的量反应的离子方程式为:![]() ,故答案为:
,故答案为:![]() ;
;
(5)X为硝酸铜,电解![]() 与
与![]() 混合溶液,阳极产生氧气,阴极先生成铜,后生成氢气,根据两极均收集到标况下2.24L气体,可知阳极一共生成0.1mol
混合溶液,阳极产生氧气,阴极先生成铜,后生成氢气,根据两极均收集到标况下2.24L气体,可知阳极一共生成0.1mol![]() ,转移0.4 mol e-,其中阴极产生0.1mol
,转移0.4 mol e-,其中阴极产生0.1mol![]() 时转移0.2 mol e-,其余便是电解
时转移0.2 mol e-,其余便是电解![]() 产生的
产生的![]() ,有0.2 mol e-转移,产生0.2mol
,有0.2 mol e-转移,产生0.2mol![]() ,故
,故![]() ,故答案为:
,故答案为:![]() 或
或 ![]() ;0.4。
;0.4。