��Ŀ����
����Ŀ����ʽ̼��ͭ���̻�ũҩ�����ϡ�ɱ�����ȷ���Ӧ�ù㷺��һ���Ի�ͭ��Cu2S������SiO2������Fe2O3�����ʣ�Ϊԭ���Ʊ���ʽ̼��ͭ��������ͼ��ʾ��

��֪�����йؽ��������γ��������������pH��Χ���£�

��[Cu(NH3)4]SO4�����ȶ�������ˮ�л�ֽ�����NH3��
��Ksp[Fe(OH)3]=4.0��10-38��
�ش��������⣺
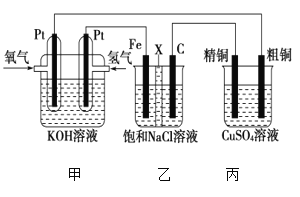
��1���ӿ�����ȡ�����ʣ�������ͭ������⣬���ɲ�ȡ�Ĵ�ʩ��___����дһ�֣���
��2������I��CS2��ȡ��ɻ��һ�ֵ���ɫ����Ʒ��������I�е���Ҫ�ɷ���___���ѧʽ�������յ���ɫ����Ʒ�������¶ȿ�����50~60��֮�䣬���˹�����͵�ԭ����___��
��3����������������ʱ������Լ�A����CuO������pH�ķ�ΧΪ___������A����Һ��pH��Ϊ5������Һ��Fe3+��Ũ��Ϊ___ mol/L��
��4��д��������������Mn2+�������з�Ӧ�����ӷ���ʽ��___��
��5�����ϰ���ʱ�������˵IJ���������___��
��6���ⶨ����ƷMnSO4��H2O��Ʒ�Ĵ��ȣ�ȷ��ȡ��Ʒ14.00g��������ˮ���100mL��Һ��ȡ��25.00mL�ñ���BaCl2��Һ�ⶨ����ȫ��Ӧ��õ���4.66g�����������Ʒ�Ĵ���Ϊ___��������С�������λ����
���𰸡����裻�ʵ���������Ũ�ȣ��ʵ����ȵ� SiO2��S��MnO2 �¶ȹ��ͣ�����ܽ�����С���¶ȹ��ߣ�CS2�ӷ� 3.7��5.6(��3.7��pH<5.6) 4.0��10-11 Mn2++HCO3-+NH3=MnCO3+NH4+ ����Һ���� 96.57%
��������
��ͭ����Ҫ�ɷ�ΪCu2S��������Fe2O3��SiO2�����ʣ�����ϡ����Ͷ������̽�ȡ��Cu2S�����������±���������������SiO2������ϡ���ᣬ����I��CS2��ȡ��ɻ��һ�ֵ���ɫ����Ʒ��˵������I�к���S�����˵õ��������к���MnO2��SiO2������S����Һ�к���Fe3+��Mn2+��Cu2+������A��������Һ��pHʹ�������γ�����������������ȥ��������̼�������Һ�����̣����˵õ�̼���̣��������ܽ⣬���������̾��壬��Һ�ϳ�����������ѭ��ʹ�ã�ͬʱ�õ���ʽ̼��ͭ���ݴ˷������
(1)�ӿ�����ȡ�����ʣ�������ͭ������⣬�������ʵ����������Ũ�ȣ���ֽ��裬���ȵȣ��ʴ�Ϊ�����衢�ʵ���������Ũ�ȡ��ʵ����ȵȣ�
(2)����I����Ҫ�ɷ�MnO2��SiO2������S�����յ���ɫ����Ʒ����S�Ĺ������¶ȿ�����50~60��֮�䣬���˹�����ͣ�ԭ�����¶ȹ��ͣ�����ܽ�����С���¶ȹ��ߣ�CS2�ӷ����ʴ�Ϊ��SiO2��S��MnO2���¶ȹ��ͣ�����ܽ�����С���¶ȹ��ߣ�CS2�ӷ���
(3)������Լ�A�����ڵ�����ҺpH���ٽ������ӵ�ˮ�⣬�������������ʣ������Ҫ�Ʊ���ʽ̼��ͭ����ɼ�������ͭ��������ͭ�ȣ������йؽ��������γ��������������pH��Χ����ҺpHӦ�ý���3.7��5.6(��3.7��pH��5.6)������A����Һ��pH��Ϊ5����c(OH-)=10-9mol/L��Ksp[Fe(OH)3]=4.0��10-38������Һ��������Ũ��Ϊ![]() mol/L=4.0��10-11 mol/L���ʴ�Ϊ��3.7��5.6(��3.7��pH��5.6)��4.0��10-11��
mol/L=4.0��10-11 mol/L���ʴ�Ϊ��3.7��5.6(��3.7��pH��5.6)��4.0��10-11��
(4)��������(��Mn2+)�����У�����̼����狀Ͱ���������̼���̳�������Ӧ�����ӷ���ʽΪMn2++HCO3-+NH3=MnCO3��+NH4+���ʴ�Ϊ��Mn2++HCO3-+NH3=MnCO3��+NH4+��
(5)�����ӷ������ϰ���ʱ�������˵IJ��������ǽ���Һ���ȣ��ʴ�Ϊ������Һ���ȣ�
(6)�ⶨMnSO4H2O��Ʒ�Ĵ��ȣ�ȷ��ȡ��Ʒ14.00g��������ˮ���100mL��Һ��ȡ��25.00mL�ñ���BaCl2��Һ�ⶨ����ȫ��Ӧ��õ���4.66g������Ϊ���ᱵ���ʵ���=![]() =0.02mol��n(MnSO4H2O)=n(BaSO4)=0.02mol�������Ʒ��MnSO4H2O���ʵ���Ϊ��0.02mol��
=0.02mol��n(MnSO4H2O)=n(BaSO4)=0.02mol�������Ʒ��MnSO4H2O���ʵ���Ϊ��0.02mol��![]() =0.08mol������Ʒ��MnSO4H2O�Ĵ���=
=0.08mol������Ʒ��MnSO4H2O�Ĵ���=![]() ��100%=96.57%���ʴ�Ϊ��96.57%��
��100%=96.57%���ʴ�Ϊ��96.57%��