题目内容
下列各溶液的叙述中不正确的是( )
A.等pH的硫酸与醋酸稀释后pH的变化如图所示,则曲线Ⅱ表示的是醋酸的稀释图像 |
| B.溶有等物质的量的NaClO、NaHCO3的溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-) |
| C.若NH4HCO3溶液、NH4HSO4溶液中c(NH4+)相等,则: c(NH4HSO4)<c(NH4HCO3) |
| D.已知某温度下Ksp(CH3COOAg) = 2.8×10-3,浓度均为0.1 mol·L-1的AgNO3溶液和CH3COONa溶液等体积混合一定能产生CH3COOAg沉淀 |
D
解析试题分析:醋酸是弱酸,边稀释边电离,溶液的PH值上升较缓慢,而硫酸是强酸,稀释时溶液PH上升较快,故比较可以得出曲线II是醋酸的稀释图像,A正确;NaClO和NaHCO3等物质的量关系,所以在溶液中有物料守恒c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-),B正确;NH4HCO3溶液发生较弱的双水解,而NH4HSO4是强酸酸式盐,水解受抑制,所以NH4HCO3溶液、NH4HSO4溶液等浓度时,前者溶液中的NH4+要小些,若c(NH4+)相等,则必然有c(NH4HSO4)<c(NH4HCO3),故C正确;浓度均为0.1 mol·L-1的AgNO3溶液和CH3COONa溶液等体积混合后体积变为原来的2倍,初始浓度变为原来的的一半0.05mol/L,因此在计算浓度商为2.5×10-3 < 2.8×10-3 ,所以一定不能产生CH3COOAg沉淀,D错误;故选D。
考点:本题考查的是强酸、弱酸的稀释、混合溶液中离子浓度大小比较、浓度商判断是否有沉淀析出等知识。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列溶液中,粒子浓度关系正确的是
| A.0.1mol/L的Na2S溶液中:2c(Na+)=c(S2-)+c(HS-)+c(H2S) |
| B.醋酸钠溶液与盐酸混合之后的中性溶液:c(Na+)> c(Cl-) >c(CH3COOH) |
| C.等浓度、等体积的氨水与盐酸的混合溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
| D.pH=4的NaHSO3溶液中:c(HSO3-)>c(SO32-)>c(H2SO3) |
已知25 ℃时有关弱酸的电离平衡常数:
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡 常数(25 ℃) | 1.8×l0-5 | 4.9×l0-10 | K1=4.3×l0-7 K2=5.6×l0-11 |
由此可得出
A.对应钠盐溶液pH关系为: pH(Na2CO3) > pH(NaCN) > pH(CH3COONa)
B.CO2通入NaCN溶液中有:CO2+H2O+2NaCN→Na2CO3+2HCN
C.冰醋酸中逐滴加水,溶液的导电性、pH均先增大后减小
D.NaHCO3和Na2CO3混合溶液中,一定有c(Na+)+c(H+)=c(OH-)+c(HCO3-) +2c(CO32-)
在t ℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t ℃时AgCl的Ksp=4×10-10,下列说法不正确的是( )
| A.在t ℃时,AgBr的Ksp为4.9×10-13 |
| B.在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点 |
| C.图中a点对应的是AgBr的不饱和溶液 |
D.在t ℃时,AgCl(s)+Br-(aq)  AgBr(s)+Cl-(aq)平衡常数K≈816 AgBr(s)+Cl-(aq)平衡常数K≈816 |
下列叙述中正确的是 ( )
| A.溶度积大的化合物溶解度一定大 |
| B.向含有AgCl固体的溶液中加入适量的水使AgCl溶解,又达到平衡时,AgCl的溶解度不变,溶度积也不变 |
| C.将难溶电解质放入纯水中,溶解达到平衡时,电解质离子的浓度的乘积就是该物质的溶度积 |
| D.AgCl水溶液的导电性很弱,所以AgCl是弱电解质 |
已知如下物质的溶度积常数:FeS,Ksp=6.3×10-18;CuS,Ksp=1.3×10-36;ZnS,Ksp=1.6×10-24。下列说法正确的是 ( )
| A.同温度下,CuS的溶解度大于ZnS的溶解度 |
| B.将足量CuSO4溶解在0.1 mol·L-1的H2S溶液中,Cu2+能达到的最大浓度为1.3×10-35mol·L-1 |
| C.因为H2SO4是强酸,所以Cu2++H2S=CuS↓+2H+不能发生 |
| D.除去工业废水中的Cu2+,可以选用FeS作沉淀剂 |
下列叙述正确的是( )
| A.某醋酸溶液的pH=a,将此溶液稀释10倍后,溶液的pH=b,则a=b+1 |
| B.在滴有酚酞溶液的氨水中,加入NH4Cl至溶液恰好无色,则此时溶液的c(NH4+) = c(Cl-) |
| C.25℃ 0.5×10-3 mol/L硫酸的pH=3.0,升高温度溶液pH增大 |
| D.100℃时,KW=10-12,若pH=1的盐酸与pH=11 NaOH溶液混合后,溶液的pH=6,则盐酸与NaOH溶液体积比为1∶1 |
下列说法正确的是( )。
A.0.1 mol·L-1的醋酸溶液加水稀释,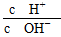 减小 减小 |
| B.体积、pH均相同的醋酸和盐酸完全溶解等量的镁粉(少量),后者用时少 |
| C.向水中加入少量固体硫酸氢钠,c(H+)增大,KW变大 |
| D.常温下,V1 L pH=11的NaOH溶液与V2 L pH=3的HA溶液混合,若混合液显中性,则V1≤V2 |
 A-+H+。将1.0 mol HA分子加入水中制得1.0 L溶液,下图中,表示溶液中HA、H+、A-的物质的量浓度随时间而变化的曲线正确的是( )
A-+H+。将1.0 mol HA分子加入水中制得1.0 L溶液,下图中,表示溶液中HA、H+、A-的物质的量浓度随时间而变化的曲线正确的是( )