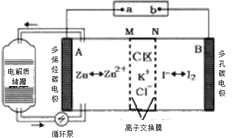
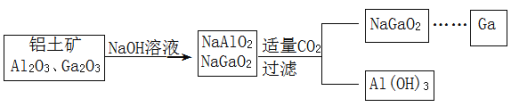
题目内容
【题目】一定温度下,在1L恒容密闭容器中加入1mol的![]() 和
和![]() 发生反应:
发生反应:![]() ;
;![]() ,
,![]() 的物质的量与时间的关系如表所示,下列说法错误的是( )
的物质的量与时间的关系如表所示,下列说法错误的是( )
时间 | 0 |
|
|
|
| 0 |
|
|
|
A.![]() 内,
内,![]()
B.升高温度,可使正反应速率减小,逆反应速率增大,故平衡逆移
C.![]() 的活化能小于
的活化能小于![]() 的活化能
的活化能
D.![]() 时再加入1mol的
时再加入1mol的![]() 和
和![]() ,反应达新平衡时,
,反应达新平衡时,![]()
【答案】B
【解析】
A.![]() 内,
内,![]() 的浓度增大
的浓度增大![]() ,则
,则![]()
![]() ,故A正确;
,故A正确;
B.升高温度正逆反应速率均增大,化学平衡向吸热方向移动,由于该反应正方向为放热反应,所以平衡逆移,故B错误;
C.![]() 正反应的活化能
正反应的活化能![]() 逆反应的活化能
逆反应的活化能![]() ,所以正反应的活化能
,所以正反应的活化能![]() 逆反应的活化能,即
逆反应的活化能,即![]() 的活化能小于
的活化能小于![]() 的活化能,故C正确;
的活化能,故C正确;
D.原来平衡时,生成氨气为![]() ,消耗氮气为
,消耗氮气为![]() ,则剩余的氮气为
,则剩余的氮气为![]() ,再加入1mol的
,再加入1mol的![]() ,平衡向正方向移动,由于可逆反应中反应物不能全部转化为生成物,所以加入的1mol的
,平衡向正方向移动,由于可逆反应中反应物不能全部转化为生成物,所以加入的1mol的![]() 不能全部反应,即后来平衡时氮气的物质的量大于
不能全部反应,即后来平衡时氮气的物质的量大于![]() ,则
,则![]() ,故D正确;
,故D正确;
答案选B。

 阅读快车系列答案
阅读快车系列答案【题目】CO2与CH4可制得合成气:CH4(g)+CO2(g)2CO(g)+2H2(g) ΔH=+247 kJ·mol-1。初始温度均为T K时,在3个容器中按不同方式投入反应物,发生上述反应,相关信息如下表:
容器 | 起始物质的量/mol | CO2平衡转化率(α) | |||||
编号 | 容积/L | 条件 | CH4(g) | CO2(g) | CO(g) | H2(g) | |
Ⅰ | 2 | 恒温恒容 | 2 | 1 | 0 | 0 | 50% |
Ⅱ | 1 | 0.5 | 1 | 0 | 0 | ||
Ⅲ | 1 | 绝热恒容 | 1 | 0.5 | 0 | 0 | - |
下列说法正确的是
A.T K时,反应CH4(g)+CO2(g)2CO(g)+2H2(g)的平衡常数为1/3
B.容器Ⅱ中反应达到平衡时,α(CO2,Ⅱ)=50%
C.容器Ⅲ中反应达到平衡时反应热在123.5—247 kJ·mol-1范围内
D.容器Ⅱ中反应达到平衡时,再投入0.5 mol CH4、0.25 mol CO,反应达到新平衡前,v(正)<v(逆)