题目内容
A、B、C、D是原子序数依次增大的四种短周期元素。请根据表中信息回答下列问题。
| 元素 | A | B | C | D |
| 性质或结构信息 | 与同主族元素原子序数相差2 | 原子的最外层电子排布式为nsnnp2n-1 | 原子序数是A、B两元素原子序数之和的2倍 | 原子半径在所属周期中最小 |
(1)写出B原子的最外层轨道排布式______________________。
(2) A与B的单质可化合生成M,A与D的单质可化合生成N,M的空间构型为_____________。M与N可以在空气中化合生成E,E的电子式为____________________,写出在E溶于水所得的溶液中各离子浓度由大到小的顺序________________________。
(3)C的单质在空气中燃烧可生成气体F,写出F与A、C形成的化合物反应的方程式,并标出电子转移的方向和数目 _ ,F与A、B、D单质中的一种在溶液中充分反应可生成两种酸,写出该反应的离子方程式 。
答案 :
:
(1)
(2)三角锥形,
c(Cl-)>c(NH4+)>c(H+)>c(OH-)
(3) SO2 +Cl2 +2H2O = 4H+ + SO42- + 2Cl-
SO2 +Cl2 +2H2O = 4H+ + SO42- + 2Cl-
解析:
A与同主族元素原子序数相差2,在短周期中只有H与Li差2,所以A为H;B原子的最外层电子排布式为nsnnp2n-1,n=2,所以B为N;C的原子序数是A、B两元素原子序数之和的2倍,所以C为S;D的原子半径在所属周期中最小,D在第三周期,所以为Cl。

练习册系列答案
相关题目
A、B、C、D是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,而辛是由C元素形成的单质.已知:甲+乙=丁+辛,甲+丙=戊+辛;常温下0.1mol/L丁溶液的pH为13,则下列说法正确的是( )
| A、元素C形成的单质可以在点燃条件分别与元素A、B、D形成的单质化合,所得化合物均存在共价键 | B、元素B、C、D的原子半径由大到小的顺序为:r(D)>r(C)>r(B) | C、1.0 L 0.1 mol/L戊溶液中含阴离子总的物质的量小于0.1 mol | D、1 mol甲与足量的乙完全反应共转移约1.204×1024个电子 |
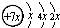 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:

 ,b与c形成化合物的电子式为
,b与c形成化合物的电子式为 ,下列比较中正确的是( )
,下列比较中正确的是( )