��Ŀ����
����Ŀ����1����ҵ����CO2��H2��Ӧ�ϳɶ����ѣ���Ӧ���Ȼ�ѧ����ʽΪ��2CO2(g)��6H2(g) ![]() CH3OCH3(g)��3H2O(g) ��H����130.8 kJ/mol����ش�
CH3OCH3(g)��3H2O(g) ��H����130.8 kJ/mol����ش�
��һ�������£�������Ӧ�ﵽƽ��״̬�����ı䷴Ӧ��ijһ�����������б仯��˵��ƽ��һ��������Ӧ�����ƶ�����________������ţ���
a���淴Ӧ������������С
b��H2��ת��������
c����Ӧ�������ٷֺ�����С
d�������е�n(CO2)/n(H2)ֵ��С
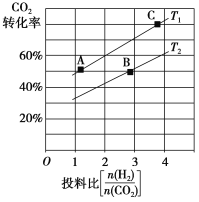
����ijѹǿ�£��ϳɶ����ѵķ�Ӧ�ڲ�ͬ�¶ȡ���ͬͶ�ϱ�ʱ��CO2��ת������ͼ��ʾ��T1�¶��£���6 mol CO2��12 mol H2����2 L���ܱ������У�5 min��Ӧ�ﵽƽ��״̬����0��5 min�ڵ�ƽ����Ӧ����v(CH3OCH3)��________��KA��KB��KC���ߵĴ�С��ϵ��_____________��
�������ϳɶ����ѵĹ����У����CO2��ת���ʿɲ�ȡ�Ĵ�ʩ��_______________ (��д����)��
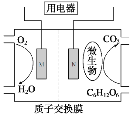
��2���ð�ˮ����CO2�ɵõ�NH4HCO3��Һ���������£�NH3��H2O�ĵ���ƽ�ⳣ��Kb��2��10-5��H2CO3�ĵ���ƽ�ⳣ��K1��4��10-7��K2��4��10-11����NH4HCO3��Һ�У�c(NH4+)________c(HCO3-)�������������������������������Լ��㳣���·�ӦNH4+��HCO3-��H2O![]() NH3��H2O��H2CO3��ƽ�ⳣ��K��___________��NH4HCO3��Һ�������غ����ʽΪ_________��
NH3��H2O��H2CO3��ƽ�ⳣ��K��___________��NH4HCO3��Һ�������غ����ʽΪ_________��
��3����ɫ��������ȼ�ϵ������������Һ�и����ĵ缫��ӦʽΪ_________________��
���𰸡�b 0.18 mol��L��1��min��1 KA��KC��KB ����Ͷ�ϱȡ�����ѹǿ�������¶ȵ�(��ѡ����) �� 1.25��10-3 c(NH4+)��c(NH3��H2O)��c(CO32-)��c(HCO3-)��c(H2CO3) CH3OCH3��12e����3H2O = 2CO2����12H��
��������
(1)��ƽ��������Ӧ�����ƶ����ı�������Ӧ�ô�������Ӧ���ʴ����淴Ӧ���ʣ��ݴ˽����жϣ���T1�¶��£���6molCO2��12molH2����2L���ܱ������У���ͼ���֪��5min��Ӧ�ﵽƽ��״̬ʱ������̼ת����Ϊ60%�����������CH3OCH3����������ƽ����Ӧ����v(CH3OCH3)=![]() ���㣻����ƽ�ⳣ�������¶��йرȽ�KA��KB��KC����֮��Ĵ�С��ϵ���۷�Ӧ2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g)Ϊ���ȷ�Ӧ�����������С�����Ӱ��ƽ���ƶ��ķ����������
���㣻����ƽ�ⳣ�������¶��йرȽ�KA��KB��KC����֮��Ĵ�С��ϵ���۷�Ӧ2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g)Ϊ���ȷ�Ӧ�����������С�����Ӱ��ƽ���ƶ��ķ����������
(2)����NH3H2O��H2CO3�ĵ���ƽ�ⳣ�������Խ��Խˮ������жϣ���ӦNH4++HCO3-+H2O=NH3H2O+H2CO3 ��ƽ�ⳣ��K=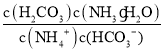 �����ˮ�����ӻ�����������𣻸���̼��������ȣ�д�������غ��ϵʽ��
�����ˮ�����ӻ�����������𣻸���̼��������ȣ�д�������غ��ϵʽ��
(3)�������Һ�����ԣ������϶�����ʧȥ�������ɶ�����̼���ݴ���д�缫��Ӧʽ��
(1)a���淴Ӧ������������С��˵��ƽ�����淴Ӧ�����ƶ�����a��ѡ��b��H2��ת��������˵��ƽ��������Ӧ�����ƶ�����bѡ��c����Ӧ�������ٷֺ�����С������ƽ�����淴Ӧ�����ƶ������С������̼������CO2������ٷֺ�����С��ƽ�����淴Ӧ�����ƶ�����c��ѡ��d��������n(CO2)/n(H2)��ֵ��С������Ϊ��СCO2������ʹƽ�����淴Ӧ�����ƶ�����d��ѡ����ѡb��
��T1�¶��£���6molCO2��12molH2����2L���ܱ������У���ͼ���֪��5min��Ӧ�ﵽƽ��״̬ʱ������̼ת����Ϊ60%��������CH3OCH3Ϊ6mol��60%��![]() =1.8mol������ƽ����Ӧ����v(CH3OCH3)=
=1.8mol������ƽ����Ӧ����v(CH3OCH3)=![]() =
= =0.18 mol��L-1��min-1����ƽ�ⳣ�������¶��йأ�����KA=KC���ָ���ͼ������ͬͶ�ϱ�ʱT1�¶��¶�����̼ת���ʴ�����T1�¶��½�T2�¶��·�Ӧ������Ӧ�����ƶ�����KA=KC��KB���ʴ�Ϊ0.18 mo��L-1��min-1��KA=KC��KB��
=0.18 mol��L-1��min-1����ƽ�ⳣ�������¶��йأ�����KA=KC���ָ���ͼ������ͬͶ�ϱ�ʱT1�¶��¶�����̼ת���ʴ�����T1�¶��½�T2�¶��·�Ӧ������Ӧ�����ƶ�����KA=KC��KB���ʴ�Ϊ0.18 mo��L-1��min-1��KA=KC��KB��
�۷�Ӧ2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g)Ϊ���ȷ�Ӧ�����������С�����CO2��ת���ʣ�Ҫ��Ӧ�����ƶ�������������ѹǿ�������¶ȣ���ͼ��֪Ͷ�ϱ�Խ��CO2��ת����ҲԽ�ʴ�Ϊ����Ͷ�ϱȡ�����ѹǿ�������¶ȵȣ�
(2)����ˮ����ɣ���֪NH3��H2O�ĵ���ƽ�ⳣ��K=2��10-5��H2CO3�ĵ���ƽ�ⳣ��K1=4��10-7��K2=4��10-11������̼�������ˮ��̶ȸ�������c(NH4+) ��c(HCO3-)����ӦNH4++HCO3-+H2O=NH3H2O+H2CO3 ��ƽ�ⳣ��K=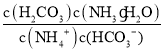 =
=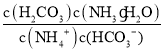 ��
��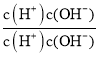 =
=![]() =
=![]() =1.25��10-3��NH4HCO3��Һ��n(N)=n(C)����Һ�е������غ�Ϊ��c(NH4+)+c(NH3H2O)=c(CO32-)+c(HCO3-)+c(H2CO3)���ʴ�Ϊ����1.25��10-3��c(NH4+)+c(NH3H2O)=c(CO32-)+c(HCO3-)+c(H2CO3)��
=1.25��10-3��NH4HCO3��Һ��n(N)=n(C)����Һ�е������غ�Ϊ��c(NH4+)+c(NH3H2O)=c(CO32-)+c(HCO3-)+c(H2CO3)���ʴ�Ϊ����1.25��10-3��c(NH4+)+c(NH3H2O)=c(CO32-)+c(HCO3-)+c(H2CO3)��
(3)������ȼ�ϵ�أ��������Һ�����ԣ����ظ����϶�����ʧȥ�������ɶ�����̼���缫��ӦʽΪCH3OCH3��12e����3H2O = 2CO2����12H�����ʴ�ΪCH3OCH3��12e����3H2O = 2CO2����12H����

 �Ķ��쳵ϵ�д�
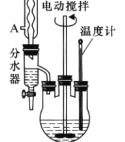
�Ķ��쳵ϵ�д�����Ŀ���������������ɱ��������Ҵ���Ũ���Ṳ���·�Ӧ�Ƶã���Ӧװ����ͼ������װ��ʡ �ԣ�����Ӧԭ�����£�
 +C2H5OH
+C2H5OH +H2O
+H2O
ʵ��������裺
��������ƿ�ڼ���12.2g �����ᡢ25mL�Ҵ���20mL ����4mLŨ���ᣬҡ�ȣ������ʯ��
��װ�Ϸ�ˮ�����綯���������¶ȼƣ���������ˮ���²�Һ��ӽ�֧��ʱ���²�Һ�������Ͳ �У��������������������Ҵ�����ƿ���а��̣�Լ3h����ֹͣ���ȡ�
�ڽ���ӦҺ����ʢ��80mL��ˮ����ƿ�У��ڽ����·�������̼���Ʒ�ĩ��Һ����Һ������ ̼�ݳ����� pH ��ֽ���������ԡ�
���÷�Һ©���ֳ��л��㣬ˮ����25mL������ȡ��Ȼ��ϲ����л��㣬����ˮCaCl2����ֲ�������������������ѡ����¶ȳ���140��ʱ��ֱ�ӽ���210-213�����֣�����ͨ������õ���������������12.8mL��
�����õ����й��������£�
��Է������� | �ܶ�/��g��cm-3�� | �е�/�� | �ܽ��� | |
������ | 122 | 1.27 | 249 | ����ˮ���������Ҵ������� |
���������� | 150 | 1.05 | 211-213 | ������ˮ���������Ҵ������� |
�Ҵ� | 46 | 0.79 | 78.5 | ������ˮ |
���� | 74 | 0.73 | 34.5 | ����ˮ |
��1����Ӧװ���з�ˮ���Ϸ�������������_______����������______��
��2��������м���Ũ�����������______��������е綯�������������_______��
��3���������ʹ�÷�ˮ����ˮ��Ŀ����______��
��4��������м���̼���Ƶ�Ŀ����______��
��5���л���ӷ�Һ©����_______��ѡ�����Ͽڵ����������¿ڷų���span>��
��6����ʵ�����õ��ı����������IJ�����_______��