题目内容
15.由CO2和H2组成的混合气体在同温同压下与氮气的密度相同.则该混合气体中,CO2和H2的物质的量之比为( )| A. | 8:13 | B. | 1:1 | C. | 13:8 | D. | 1:2 |
分析 同温同压下气体密度之比等于其摩尔质量之比,则混合气体平均相对分子质量为28,依据摩尔质量公式M=$\frac{m}{n}$计算解答.
解答 解:同温同压下气体密度之比等于其摩尔质量之比,而由CO2和H2组成的混合气体在同温同压下与氮气的密度相同,则混合气体平均相对分子质量为28,设二氧化碳物质的量为xmol,氢气的物质的量为ymol,则:
M=$\frac{m}{n}$=$\frac{44x+2y}{x+y}$=28,解得x:y=13:8;
故选:C.
点评 本题考查了有关物质的量计算,熟悉以物质的量为核心的计算公式,熟悉阿伏伽德罗定律推论是解题关键,题目难度不大.

练习册系列答案
 全能练考卷系列答案
全能练考卷系列答案
相关题目
5.自然环境与人们的生活息息相关.下列有关环境问题的说法不正确的是( )
| A. | 氟利昂(CCl2F2)因破坏大气臭氧层而导致“温室效应” | |
| B. | 将垃圾分类并回收利用是垃圾处理的发展方向 | |
| C. | 废旧电池的回收,其主要目的是保护环境,而不是回收金属 | |
| D. | 淀粉餐具被认为是有发展前景的一次性餐具,可有利于保护环境 |
6.化学与生活、社会密切相关,下列说法正确的是( )
| A. | SO2可以用来漂白纸浆、毛、丝、草帽辫、增白食品等 | |
| B. | 通信光缆的主要成分是晶体Si,太阳能电池的材料主要是SiO2 | |
| C. | 高锰酸钾溶液、酒精、双氧水都能杀菌消毒,都利用了强氧化性 | |
| D. | 氨很容易液化,液氨气化吸收大量的热,所以液氨常用作致冷剂 |
10.下列有机物属于烃类的是( )
| A. | CH3Cl | B. | C2H6 | C. | C2H5OH | D. | CH3COOH |
20.已知Iˉ、Fe2+、SO2、Clˉ、H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为Clˉ<Fe2+<H2O2<Iˉ<SO2.则下列反应不能发生的是( )
| A. | 2Fe3++SO2+2H2O=2Fe2++SO42ˉ+4H+ | B. | Cl2+SO2+2H2O=H2SO4+2HCl | ||
| C. | H2O2+2H++SO42ˉ=SO2↑+O2↑+2H2O | D. | 2Iˉ+2H++H2O2=2H2O+I2 |
4.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 1mol•L-1的NaCl 溶液中含有Cl-的数目为NA | |
| B. | 78g 苯含有C=C双键的数目为3NA | |
| C. | 常温常压下,14g由N2与CO组成的混合气体含有的原子数目为NA | |
| D. | 标准状况下,6.72L NO2与水充分反应转移的电子数目为0.1NA |
5.下列轨道表示式能表示氮原子的最低能量状态的是( )
| A. |  | B. |  | ||
| C. |  | D. |  |
 甲是一种可用于净水和膨化食品的盐,由A、B、C、D、E五种短周期元素组成.甲溶于水后可电离出三种离子,其中一种是由A、B形成的10电子阳离子.A元素原子核内质子数比E的少l,D、E同主族.某同学为探究甲的组成而进行如下实验:
甲是一种可用于净水和膨化食品的盐,由A、B、C、D、E五种短周期元素组成.甲溶于水后可电离出三种离子,其中一种是由A、B形成的10电子阳离子.A元素原子核内质子数比E的少l,D、E同主族.某同学为探究甲的组成而进行如下实验: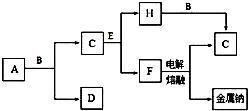 中学化学中常见的几种物质存在如图所示的转化关系,其中,A是一种黑色粉末状固体,C是一种黄绿色气体.实验室中常用E溶液吸收多余的C.(图中部分产物和反应条件已略去).
中学化学中常见的几种物质存在如图所示的转化关系,其中,A是一种黑色粉末状固体,C是一种黄绿色气体.实验室中常用E溶液吸收多余的C.(图中部分产物和反应条件已略去).