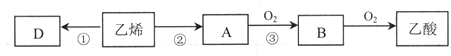
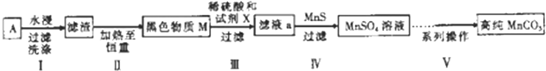
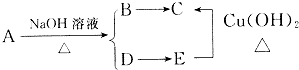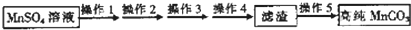题目内容
在常温下,将等体积的盐酸和氨水混和后,所得溶液的pH=7,则下列说法正确的是( )
| A、原来盐酸的物质的量浓度等于氨水的物质的量浓度 |
| B、所得溶液中c(NH4+)=c(Cl-) |
| C、所得溶液中c(NH4+)+c(H+)=c(Cl-) |
| D、所得溶液中c(NH4+)+c(NH3?H2O)=c(Cl-) |
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:盐酸和氨水混和,若恰好中和生成氯化铵,铵根水解导致溶液显酸性,现显中性,说明氨水过量,结合溶液中的电荷守恒降低该题.
解答:
解:A、盐酸和氨水混和,若恰好中和生成氯化铵,铵根水解导致溶液显酸性,现显中性,说明氨水过量,故A错误;
B、溶液中存在电荷守恒,即c(NH4+)+c(H+)=c(Cl-)+c(OH-),溶液的pH=7,说明氢离子浓度等于氢氧根离子浓度,所以c(NH4+)=c(Cl-),故B正确;
C、溶液中存在电荷守恒,即c(NH4+)+c(H+)=c(Cl-)+c(OH-),故C错误;
D、若只有氯化铵,依据物料守恒c(NH4+)+c(NH3?H2O)=c(Cl-),但铵根还有氨水电离出来的,所以c(NH4+)+c(NH3?H2O)>c(Cl-),故D错误;
故选B.
B、溶液中存在电荷守恒,即c(NH4+)+c(H+)=c(Cl-)+c(OH-),溶液的pH=7,说明氢离子浓度等于氢氧根离子浓度,所以c(NH4+)=c(Cl-),故B正确;
C、溶液中存在电荷守恒,即c(NH4+)+c(H+)=c(Cl-)+c(OH-),故C错误;
D、若只有氯化铵,依据物料守恒c(NH4+)+c(NH3?H2O)=c(Cl-),但铵根还有氨水电离出来的,所以c(NH4+)+c(NH3?H2O)>c(Cl-),故D错误;
故选B.
点评:本题考查了盐类水解和溶液中的电荷守恒和物料守恒,注意物料守恒中离子的来源分析,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列事实不能用勒夏特列原理解释的是( )
| A、溴水中有下列平衡Br2+H2O?HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅 |
| B、加催化剂,使N2和H2在一定条件下转化为NH3 |
| C、反应CO(g)+NO2(g)═CO2(g)+NO(g)△H<0,达平衡后,升高温度体系颜色变深 |
| D、增大压强,有利于SO2与O2反应生成SO3 |
下列化学用语正确的是( )
A、NaCl的电子式: |
| B、乙醇的结构简式:C2H6O |
C、Mg原子结构示意图: |
| D、乙酸乙酯的分子式:C4H8O2 |
原子序数小于18的元素X,其基态原子L层中有3个未成对电子,则关于这种元素的说法中错误的是( )
| A、该元素是非金属元素 |
| B、该元素最外层有三个电子 |
| C、该元素所形成的最高价氧化物的水化物是一种强酸 |
| D、该元素的第一电离能比同周期右边相邻的元素的第一电离能大 |