题目内容
【题目】(多选)氧化铜矿用稀硫酸溶解后所得酸浸液(含Cu2+、H+、SO42﹣、Mg2+、A13+、Fe2+) 经下列流程可制得高纯度硫酸铜晶体如图1: 
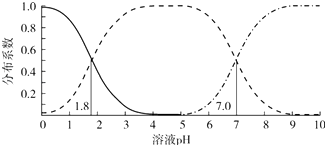
已知:该实验条件下,各金属离子沉淀的pH如图2所示.下列判断正确的是( )
A.沉淀1的主要成分为Al(OH)3和Fe(OH)3
B.溶液2中所含金属阳离子只有Mg2+
C.将溶液3蒸干即得CuSO45H2O晶体
D.若不加入NaClO溶液,对制得硫酸铜晶体的纯度将无影响
【答案】AD
【解析】解:氧化铜矿用稀硫酸溶解后所得酸浸液(含Cu2+、H+、SO42﹣、Mg2+、A13+、Fe2+),加NaClO溶液,把亚铁离子氧化为Fe3+ , 调节溶液的pH=4.7,由各金属离子沉淀的pH图可知,A13+、Fe3+转化为Al(OH)3和Fe(OH)3沉淀,过滤,沉淀1为Al(OH)3和Fe(OH)3 , 溶液1含有Cu2+、H+、SO42﹣、Mg2+ , 然后加NaOH,调节pH=6.7,Cu2+转化为Cu(OH)2沉淀,过滤,沉淀2为Cu(OH)2 , 溶液2主要含有Mg2+ , Cu(OH)2加硫酸生成溶液3为硫酸铜溶液,然后加热浓缩、冷却结晶得到硫酸铜晶体;A.由流程分析可知,沉淀1的主要成分为Al(OH)3和Fe(OH)3 , 故A正确;
B.溶液2主要含有Mg2+ , 还有少量的Cu2+、A13+、Fe3+ , 因为Cu2+、A13+、Fe3+不能全部转化为沉淀,故B错误;
C.从溶液中提取溶质时,加热浓缩、冷却结晶,不能加热干,故C错误;
D.若不加入NaClO溶液,在调节pH=4.7时,Fe2+不能转化为沉淀,在调节pH=6.7,Cu2+转化为Cu(OH)2沉淀,而此时Fe2+不能转化为沉淀,所以对制得硫酸铜晶体的纯度将无影响,故D正确.
故选AD.