题目内容
【题目】按照下列图表和有关要求回答问题:
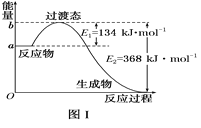
(1)图Ⅰ是1 mol NO2(g)和1 mol CO(g)反应生成CO2和NO过程中能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是_________(填“增大”“减小”或“不变”,下同),ΔH的变化是_________。请写出NO2和CO反应的热化学方程式:___________________________。
(2) 甲醇既是重要的化工原料,又可作为燃料。
Ⅰ.利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇。发生的主要反应如下:
①CO(g)+2H2(g)=CH3OH(g) ΔH1
②CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH2
③CO2(g)+H2(g)=CO(g)+H2O(g) ΔH3
已知反应①中相关的化学键键能数据如下:
化学键 | H-H | C-O |
| H-O | C-H |
E/(kJ·mol-1) | 436 | 343 | 1 076 | 465 | 413 |
由此计算ΔH1=_________kJ·mol-1;已知ΔH2=-58 kJ·mol-1,则ΔH3=______kJ·mol-1。
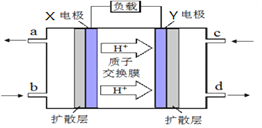
Ⅱ.甲醇质子交换膜燃料电池的工作原理如上图所示,写出X电极的电极反应式_______________。
(3) 下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
X与Z两元素的单质反应生成1molX的最高价化合物,恢复至室温,放热687kJ,已知该化合物的熔、沸点分别为-69℃和58℃,写出该反应的热化学方程式: __________________。
【答案】 减小 不变 NO2(g)+CO(g)===CO2(g)+NO(g) ΔH=-234 kJ·mol-1 -99 +41 CH3OH-6e-+H2O ===CO2+6H+ Si(s)+2Cl2(g)=SiCl4(l)△H=-687kJ/mol
【解析】(1)加入催化剂能降低反应所需的活化能,则E1和E2都减小,催化剂不能改变反应物的总能量和生成物的总能量之差,即反应热不改变,所以催化剂对反应热无影响,由图可知,1mol NO2和1mol CO反应生成CO2和NO放出热量368-134=234kJ,反应热化学方程式为NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJmol-1,故答案为:减小;不变;NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJmol-1;
(2)Ⅰ.反应热=反应物总键能-生成物总键能,故△H1=1076kJmol-1+2×436kJmol-1 -(3×413+343+465)kJmol-1 =-99kJmol-1,根据盖斯定律:反应②-反应①=反应③,故△H3 =△H2-△H1 =-58kJmol-1-(-99kJmol-1)=+41kJmol-1,故答案为:-99;+41;
Ⅱ.根据氢离子移动方向知,X是负极、Y是正极,该原电池是燃料电池,则X电极上甲醇失电子发生氧化反应、Y电极上氧气得电子发生还原反应,X电极上甲醇失电子生成二氧化碳和氢离子,电极反应式为CH3OH-6e-+H2O =CO2+6H+,故答案为:CH3OH-6e-+H2O =CO2+6H+;
(3)X与Z两元素的单质分别为Si、氯气,二者反应生成的最高价化合物为四氯化硅,已知该化合物的熔、沸点分别为-69℃和58℃,则室温下四氯化硅为液态,则该反应的热化学方程式为:Si(s)+2Cl2(g)=SiCl4(l)△H=-687kJ/mol,故答案为:Si(s)+2Cl2(g)=SiCl4(l)△H=-687kJ/mol。