题目内容
锌锰废电池经处理后,生产并回收硫酸锌及碳酸锰,其中生产工业级碳酸锰工艺如下:
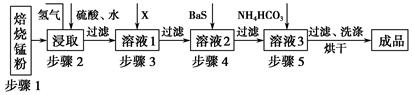
试回答下列问题:
(1)锰在元素周期表中位于第________周期,第________族。
(2)步骤1和步骤2是将MnO2转化为MnO并溶于硫酸,其中步骤2中的氢气,是另一个流程产生的副产品,请写出产生氢气的反应方程式__________________________。
(3)步骤3和步骤4都是除杂质。
①X是一种“绿色”氧化剂,则X是________(填化学式)。
②步骤3是除去杂质Fe2+。请用文字和必要的方程式简述除去Fe2+的方法(已知三种离子沉淀的pH范围为Fe3+:2.7~3.7,Mn2+:8.6~10.1,Fe2+:7.6~9.6)_________________________________________________________。
③步骤4中主要反应方程式为:MeSO4+BaS=MeS↓+BaSO4↓(Me主要为Pb、Cd、Hg等),则其除去杂质的原理是_________________________________________________。
(4)已知进行步骤5的操作时,溶液3(主要成分为MnSO4)会产生大量无色无味的气泡,则步骤5反应的化学方程式为_______________________________________。

试回答下列问题:
(1)锰在元素周期表中位于第________周期,第________族。
(2)步骤1和步骤2是将MnO2转化为MnO并溶于硫酸,其中步骤2中的氢气,是另一个流程产生的副产品,请写出产生氢气的反应方程式__________________________。
(3)步骤3和步骤4都是除杂质。
①X是一种“绿色”氧化剂,则X是________(填化学式)。
②步骤3是除去杂质Fe2+。请用文字和必要的方程式简述除去Fe2+的方法(已知三种离子沉淀的pH范围为Fe3+:2.7~3.7,Mn2+:8.6~10.1,Fe2+:7.6~9.6)_________________________________________________________。
③步骤4中主要反应方程式为:MeSO4+BaS=MeS↓+BaSO4↓(Me主要为Pb、Cd、Hg等),则其除去杂质的原理是_________________________________________________。
(4)已知进行步骤5的操作时,溶液3(主要成分为MnSO4)会产生大量无色无味的气泡,则步骤5反应的化学方程式为_______________________________________。
(1)四 ⅦB
(2)Zn+H2SO4=ZnSO4+H2↑
(3)①H2O2 ②在酸性条件下加入双氧水,将Fe2+氧化成Fe3+、2Fe2++H2O2+2H+=2Fe3++2H2O,调节pH至3.7~8.6,使Fe3+沉淀完全,Fe3++3H2O??Fe(OH)3+3H+ ③以BaS为沉淀剂,使Pb2+、Cd2+、Hg+等金属离子,生成更难溶的硫化物而除去
(4)MnSO4+2NH4HCO3=(NH4)2SO4+MnCO3↓+H2O+CO2↑
(2)Zn+H2SO4=ZnSO4+H2↑
(3)①H2O2 ②在酸性条件下加入双氧水,将Fe2+氧化成Fe3+、2Fe2++H2O2+2H+=2Fe3++2H2O,调节pH至3.7~8.6,使Fe3+沉淀完全,Fe3++3H2O??Fe(OH)3+3H+ ③以BaS为沉淀剂,使Pb2+、Cd2+、Hg+等金属离子,生成更难溶的硫化物而除去
(4)MnSO4+2NH4HCO3=(NH4)2SO4+MnCO3↓+H2O+CO2↑
(2)废电池回收硫酸锌和碳酸锰,故另一个工艺是制取硫酸锌,锌皮与稀硫酸反应生成氢气:Zn+H2SO4=ZnSO4+H2↑
(3)①具有强氧化性的“绿色”氧化剂,显然是H2O2,它的加入也不会引入新的杂质。②由题给的三种离子沉淀pH可知,为除去Fe2+、Fe3+,应将Fe2+先氧化为Fe3+,然后调节溶液的pH在3.7~8.6之间,以便除净Fe3+而不损失Mn2+。③难溶电解质有生成更难溶电解质的趋势,故利用沉淀的转化实现了除去Pb2+、Cd2+、Hg+。
(4)根据气体是无色无味,可知该气体是CO2,故该反应的化学方程式为MnSO4+2NH4HCO3=(NH4)2SO4+MnCO3↓+CO2↑+H2O。
(3)①具有强氧化性的“绿色”氧化剂,显然是H2O2,它的加入也不会引入新的杂质。②由题给的三种离子沉淀pH可知,为除去Fe2+、Fe3+,应将Fe2+先氧化为Fe3+,然后调节溶液的pH在3.7~8.6之间,以便除净Fe3+而不损失Mn2+。③难溶电解质有生成更难溶电解质的趋势,故利用沉淀的转化实现了除去Pb2+、Cd2+、Hg+。
(4)根据气体是无色无味,可知该气体是CO2,故该反应的化学方程式为MnSO4+2NH4HCO3=(NH4)2SO4+MnCO3↓+CO2↑+H2O。

练习册系列答案
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案
相关题目

 溶液中发生反应的化学方程式为 。
溶液中发生反应的化学方程式为 。
 ,而不用MgO,其原因是
,而不用MgO,其原因是 2Hg+O2↑
2Hg+O2↑ 4Al+3O2↑
4Al+3O2↑ 2Cu+SO2
2Cu+SO2 2Al+3Cl2↑
2Al+3Cl2↑ Mg+H2O
Mg+H2O Zn+CO2
Zn+CO2