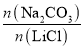题目内容
【题目】现有下列各化合物:
A.CH3CH2CH2CHO与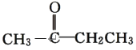
B.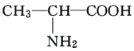 与
与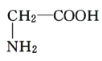
C. ![]() 与
与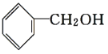
D.CH3CH≡CH与CH2=CH—CH=CH2
E. 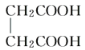 与
与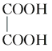
F.戊烯与环戊烷
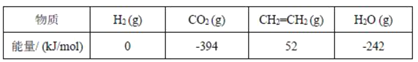
(1)上述各组化合物中属于同系物的是________,属于同分异构体的是________(填字母)。
(2)上述A中两化合物的含氧官能团是__________和 __________(写名称)。
(3)根据官能团的特点可将C中两种化合物划分为________类和________类。
【答案】BE AF 醛基 羰基 酚 醇
【解析】
同系物是结构相似,分子组成上相差1个或若干个亚甲基原子团的一系列物质的互称;同分异构体是分子式相同,结构不同的化合物的互称。据此判断。
A.CH3CH2CH2CHO与 由结构简式可知两者的分子式相同,但结构不同,互为同分异构体。
由结构简式可知两者的分子式相同,但结构不同,互为同分异构体。
B. 与
与 ,两者结构相似,组成上相差1个亚甲基,属于同系物关系。
,两者结构相似,组成上相差1个亚甲基,属于同系物关系。
C. ![]() 与
与 ,前者羟基连在苯环上,属于酚类,后者羟基连在烃基侧链上属于醇类。
,前者羟基连在苯环上,属于酚类,后者羟基连在烃基侧链上属于醇类。
D.CH3CH≡CH与CH2=CH—CH=CH2两者分子式不同,所含官能团也不同,前者是炔烃,后者是二烯烃,没有互称关系。
E.  与
与 ,两者所含官能团的种类和个数相同,分子组成上相差2个亚甲基,属于同系物关系。
,两者所含官能团的种类和个数相同,分子组成上相差2个亚甲基,属于同系物关系。
F.戊烯与环戊烷,两者分子式均为C5H10,前者是链状烯烃,后者是环状烷烃,结构不同,互为同分异构体。
(1)上述各组化合物中属于同系物的是BE;属于同分异构体的是AF,故答案为:BE;AF。
(2)上述A中两化合物的含氧官能团是醛基和羰基,故答案为:醛基;羰基。
(3)根据官能团的特点C中两种化合物划分为酚类和醇类,故答案为:酚;醇。

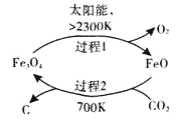
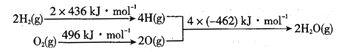
【题目】对工业废气进行脱硝有多种方法。
(1)用活性炭还原法处理氮氧化物的反应为C(s)+2NO(g)![]() N2(g)+CO2(g)。一定条件下按下表所示条件向体积固定的容器中充入物质发生该反应。
N2(g)+CO2(g)。一定条件下按下表所示条件向体积固定的容器中充入物质发生该反应。
容器 | 温度 | 体积 | C(s) | NO(g) | N2(g) | CO2(g) |
甲 | 600℃ | V L | 1mol | 2mol | 0 | 0 |
乙 | 600℃ | V L | 0 | 0 | 2mol | 2mol |
①下列能说明甲容器中反应达到平衡状态的是_______。
a.容器的压强保持不变 b.v(NO)正=2v(CO2)逆
c.混合气体的密度保持不变 d.NO、N2、CO2的物质的量之比为2∶1∶1
②关于平衡时的甲、乙两容器,下列说法一定正确的是_______。
a.p(甲)=p(乙) b.c(NO)甲=c(CO2)乙
c.2c(CO2)甲=c(N2)乙 d.体积分数φ(CO2)甲=φ(N2)乙
(2)氮氧化物与悬浮在大气中的海盐粒子相互作用生成亚硝酰氯(ClNO),涉及反应如下:4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g) K1 ;2NO2(g)+NaCl(s)
2NaNO3(s)+2NO(g)+Cl2(g) K1 ;2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) K2;2NO(g)+Cl2(g)
NaNO3(s)+ClNO(g) K2;2NO(g)+Cl2(g)![]() 2ClNO(g) K3;则K1、K2 、K3之间的关系为K3=_______
2ClNO(g) K3;则K1、K2 、K3之间的关系为K3=_______
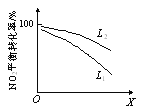
(3)利用O3进行如下脱硝反应:2NO2(g)+O3(g)![]() N2O5(g)+O2(g) ΔH<0。其他条件一定时,NO2(g)的平衡转化率随温度和压强的变化情况如下图甲所示。X表示_______(填“压强”或“温度”),L1_______L2(填“<”或“>”)。
N2O5(g)+O2(g) ΔH<0。其他条件一定时,NO2(g)的平衡转化率随温度和压强的变化情况如下图甲所示。X表示_______(填“压强”或“温度”),L1_______L2(填“<”或“>”)。
(4)用稀硝酸吸收NOx进行脱硝,得到HNO3和HNO2(弱酸)的混合溶液,电解该混合溶液可获得较浓的硝酸。写出电解时阳极的电极反应式:_______。
【题目】LiCoO2(钴酸锂)是锂离子电池的正极材料。以某海水为原料制备钴酸锂的一种流程如下:
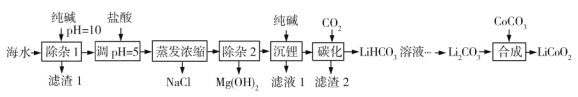
已知如下信息:
①该海水中含浓度较大的LiCl,含少量MgCl2、CaCl2、MnCl2等。
②碳酸锂的溶解度与温度关系如图所示:

③常温下,几种难溶物质的溶度积数据如下:
物质 | Li2CO3 | MgCO3 | CaCO3 | MnCO3 | Mg(OH)2 |
Ksp | 2.5×102 | 6.8×106 | 2.8×109 | 2.3×1011 | 6.0×1010 |
请回答下列问题:
(1)LiCoO2中钴的化合价为________。滤渣1主要成分有MgCO3、Mg(OH)2、CaCO3和__________(填化学式)。
(2)调节pH=5的目的是__________。
(3)“沉锂”包括过滤、洗涤等,宜用_________(填“热水”或“冷水”)洗涤Li2CO3。加入纯碱的量与锂回收率的关系如表所示:
序号 |
| 沉淀质量/g | 碳酸锂含量/% | 锂回收率/% |
① | 0.9∶1 | 10.09 | 92.36 | 77.67 |
② | 1.0∶1 | 10.97 | 90.19 | 82.46 |
③ | 1.1∶1 | 11.45 | 89.37 | 85.27 |
④ | 1.2∶1 | 12.14 | 84.82 | 85.45 |
从生产成本考虑,宜选择_______(填序号)方案投料。
(4)“除杂2”中调pH=13时c(Mg2+)=_________mol·L-1。
(5)“合成”中采用高温条件,放出一种能使澄清石灰水变浑浊的气体。写出“合成”发生反应的化学方程式________。
(6)在“合成”中制备1 mol LiCoO2转移电子的物质的量为__________。