题目内容
pH为2的氢氟酸溶液稀释100倍后,pH<4.则25℃时,将0.1mol?L-1的HF加水不断稀释,下列始终保持增大趋势的量是( )
| A、C(H+) | ||
| B、c(H+)?c(OH-) | ||
| C、C(OH-) | ||
D、
|
考点:弱电解质在水溶液中的电离平衡
专题:
分析:pH为2的氢氟酸稀释100倍后,pH<4,说明氢氟酸为弱电解质,溶液中存在电离平衡,加水稀释促进氢氟酸电离,但溶液中氢离子浓度减小,温度不变,水的离子积常数不变,据此分析解答.
解答:
解:pH为2的氢氟酸稀释100倍后,pH<4,说明氢氟酸为弱电解质,溶液中存在电离平衡,
A、加水稀释促进氢氟酸电离,但溶液中氢离子增大程度小于溶液体积增大程度,所以氢离子浓度减小,故A错误;
B、温度不变,水的离子积常数不变,故B错误;
C、加水稀释后,溶液酸性减弱,氢离子浓度减小,溶液中氢氧根离子浓度增大,故C正确;
D、加水稀释促进氢氟酸电离,但温度不变,氢氟酸的电离平衡常数不变,故D错误;
故选C.
A、加水稀释促进氢氟酸电离,但溶液中氢离子增大程度小于溶液体积增大程度,所以氢离子浓度减小,故A错误;
B、温度不变,水的离子积常数不变,故B错误;
C、加水稀释后,溶液酸性减弱,氢离子浓度减小,溶液中氢氧根离子浓度增大,故C正确;
D、加水稀释促进氢氟酸电离,但温度不变,氢氟酸的电离平衡常数不变,故D错误;
故选C.
点评:本题考查了弱电解质的电离,明确弱电解质电离特点及影响平衡常数的因素是解本题关键,注意弱电解质的电离平衡常数只与温度有关,与溶液的酸碱性及浓度无关,为易错点.

练习册系列答案
相关题目
在无色溶液中能大量共存的离子组是( )
| A、Ca2+、Cl-、CO32- |
| B、K+、Na+、SO42- |
| C、HCO3-、Na+、OH- |
| D、K+、Fe3+、SCN- |
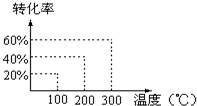 将X和Y以1:2的体积比混合后置于密闭容器中,加压到3×107Pa,发生如下反应:(g)+2Y(g)?2Z(g),达到平衡状态时,测得反应物的总物质的量和生成物的总物质的量相等,有关数据如图,则反应对应的温度是( )
将X和Y以1:2的体积比混合后置于密闭容器中,加压到3×107Pa,发生如下反应:(g)+2Y(g)?2Z(g),达到平衡状态时,测得反应物的总物质的量和生成物的总物质的量相等,有关数据如图,则反应对应的温度是( )| A、100℃ | B、200℃ |
| C、300℃ | D、不能确定 |
在容积不变的密闭容器中存在如下反应:2A(g)+B(g)═3C(g)+D(s)△H<0,某研究小组研究了在其他条件不变时,改变某一条件对上述反应的影响,下列分析不正确的是( )
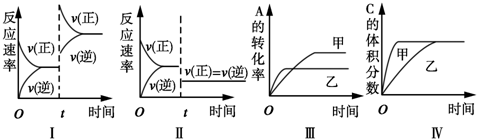

| A、图Ⅰ表示增加反应物浓度对该平衡的影响 |
| B、图Ⅱ表示减小压强对该平衡的影响 |
| C、图Ⅲ表示温度对该平衡的影响,温度:乙>甲 |
| D、图Ⅳ表示催化剂对该平衡的影响,催化效率:甲>乙 |
晶胞是晶体结构中可重复出现的最小的结构单元,C60晶胞结构如图所示,下列说法正确的是( )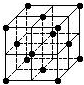

| A、C60属于离子晶体 |
| B、C60摩尔质量是720 |
| C、在C60晶胞中平均每个晶胞有14个C60分子 |
| D、每个C60分子周围与它距离最近等距离的C60分子有12个 |
如图所示是配制一定物质的量浓度溶液的过程示意图.下列说法中错误的是( )
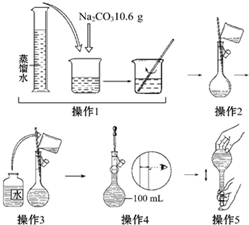

| A、所配制的Na2CO3溶液的物质的量浓度为1.0 mol?L-1 |
| B、操作2是将溶解的Na2CO3溶液转移到容量瓶中 |
| C、操作4如果仰视,结果配得溶液浓度偏低 |
| D、操作5中,定容摇匀后发现液面低于刻度线,要继续加水至液面与刻度线平齐 |
下列实验操作中正确的是( )
| A、蒸馏操作时,温度计水银球靠近蒸馏烧瓶的底部,且向蒸馏液体中加入几块沸石,以防止暴沸 |
| B、蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 |
| C、焰色反应每次实验都要先用稀硫酸洗净铂丝 |
| D、过滤、结晶、灼烧、萃取、分液和蒸馏等都是常用的分离混合物的方法 |
关于物质的变化、性质及用途,下列叙述中正确的是( )
| A、化学变化中有化学键的断裂与生成,并伴有能量的变化,物理变化二者都不具备 |
| B、简单非金属阴离子只有还原性,而简单金属阳离子只有氧化性 |
| C、工业上用石灰乳对煤燃烧后形成的烟气进行脱硫,最终能制得石膏 |
| D、Al2O3具有很高的熔点,可用于制造熔融烧碱的坩埚 |
