题目内容
【题目】化学科学的形成、发展与应用过程中,下列科学家与其成就不相对应的是
A.1961年英国科学家波义尔提出化学元素的概念
B.1774年法国科学家拉瓦锡提出燃烧的氧化学说
C.1811年意大利科学家阿伏加德罗提出原子学说
D.1943年,科学家侯德榜发明联合制碱法
【答案】C
【解析】
A. 波义尔提出化学元素的概念,故A说法正确;
B. 拉瓦锡提出燃烧作用的氧化学说,故B说法正确;
C. 道尔顿提出原子学说,阿伏加德罗提出阿伏加德罗常数、阿伏加德罗定律,故C说法错误;
D. 候德榜发明联合制碱法,故D说法正确;
答案:C。

【题目】以反应5H2C2O4+2MnO4-+6H+===10CO2↑+2Mn2++8H2O为例探究“外界条件对化学反应速率的影响”。实验时,分别量取H2C2O4溶液和酸性KMnO4溶液,迅速混合并开始计时,通过测定溶液褪色所需时间来判断反应的快慢。
编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
浓度/mol·L-1 | 体积/mL | 浓度/mol·L-1 | 体积/mL | ||
① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
下列说法不正确的是
A. 实验①、②、③所加的H2C2O4溶液均要过量
B. 实验①测得KMnO4溶液的褪色时间为40 s,则这段时间内平均反应速率υ(KMnO4)=2.5×10-4mol·L-1·s-1
C. 若生成a L CO2(标准状况),该反应转移的电子数为aNA/22.4
D. 实验①和②起初反应均很慢,过了一会儿速率突然增大,可能是生成的Mn2+对反应起催化作用
【题目】卤块的主要成分是MgCl2,此外还含Fe3+、Fe2+和Mn2+等离子的易溶盐。以卤块为原料可制得轻质氧化镁,工艺流程如图:
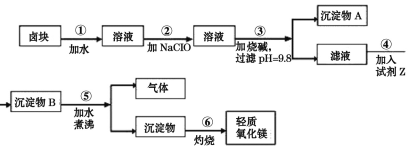
已知:(1)Fe2+氢氧化物呈絮状,不易从溶液中除去,常将它氧化为Fe3+,生成Fe(OH)3沉淀除去。
(2)原料价格表
物质 | 价格/(元·吨-1) |
漂液(含25.2%NaClO) | 450 |
双氧水(含30%H2O2) | 2400 |
烧碱(含98%NaOH) | 2100 |
纯碱(含99.5%Na2CO3) | 600 |
(3)生成氢氧化物沉淀的PH
物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2 | 7.6 | 9.6 |
Mn(OH)2 | 8.3 | 9.8 |
Mg(OH)2 | 9.6 | 11.1 |
回答下列问题:
(1)某课外兴趣小组设计实验证明卤块中含有Fe3+为:取少许样品加水溶解,____,则说明卤块中含Fe3+。
(2)工业上冶炼镁常用的方法的化学方程式为____。
(3)步骤②加入NaClO而不用H2O2的原因是____,步骤②反应后产生少量红褐色沉淀,该反应中氧化剂与还原剂的比例为____。
(4)沉淀A的主要成分为____;步骤④加入的物质为____。
(5)步骤⑤发生的反应的化学方程式为____。
(6)步骤⑥如在实验室进行,应选用在____(填仪器名称)中灼烧。