题目内容
有5种短周期元素的原子序数按E、D、B、A、C的顺序依次增大;A、C同周期,B、C同主族;A与B可形成离子化合物A2B,A2B中所有粒子的电子数相同,且电子总数为30;D和E可形成4核10电子的分子。试回答下列问题:
(1)用电子式表示离子化合物A2B的形成过程:__________________________________________________________________________。
(2)写出下列物质的电子式:
D元素形成的单质__________;B与E形成的化合物E2B__________;A、B、E形成的化合物__________;D、E形成的化合物__________。
(1)
(2)



解析

练习册系列答案
相关题目
元素周期表是学习化学的重要工具,它隐含许多信息和规律。下表所列是五种短周期元素的原子半径及主要化合价:
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.16 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | +2 | -2 |
(1)在下表中标出上述五种元素在元素周期表中的对应位置(用元素符号)。
(2)在下表中标明通常寻找催化剂材料的区域(用斜线阴影)。
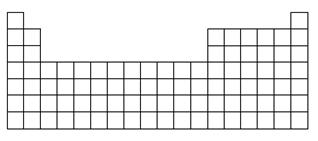
(3)A、B、E三种元素各自形成简单离子,其中半径最大的为________(填离子符号)。
(4)证明B元素的单质与A元素的单质在化学性质上有明显不同的离子方程式为:________________________。
(5)周期表中有些处于对角(左上→右下)位置的元素,它们的单质及其化合物的性质存在“对角线相似”的现象,请写出D的氧化物与强碱溶液反应的离子方程式:________________________。
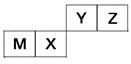
A、B、C为短周期元素,在周期表中所处的位置如图所示。
| A | | C |
| | B | |
(1)写出A、B元素的名称________、________。
(2)B位于元素周期表中第________周期第________族。
(3)C的原子结构示意图为________。
(4)写出A的气态氢化物与其最高价氧化物对应的水化物反应的化学方程式________________________________________________________________。
下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:
| 周期 | ⅠA | | 0 | |||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | | | | ② | ③ | ④ | | |
| 3 | ⑤ | | ⑥ | | | ⑦ | ⑧ | |
(1)请画出元素⑥的离子结构示意图: 。
(2)元素⑦中质子数和中子数相等的同位素符号是: 。
(3)④、⑤、⑦的离子半径由大到小的顺序为: 。
(4)②的最高价氧化物对应水化物的电离方程式为: 。
(5)④、⑤两种元素的原子按1:1组成的常见化合物的电子式为: 。
(6)由表中两种元素形成的5核10电子分子常做燃料电池的燃料,该电池在碱性条件下的负极反应式为: 。
(7)由表中两种元素形成的氢化物A和B都含有18个电子,A是一种6原子分子,可做火箭发动机燃料;B是一种常见强氧化剂。已知16g液态A与液态B充分反应生成一种液态10电子分子和一种气态单质,并放出838kJ热量,写出A与B反应的热化学方程式: 。
A、B、D、E四种元素均为短周期元素,原子序数逐渐增大。A元素原子的核外电子数、电子层数和最外层电子数均相等。B、D、E三种元素在周期表中的相对位置如图①所示,只有E元素的单质能与水反应生成两种酸。甲、乙、M、W、X、Y、Z七种物质均由A、B、D三种元素中的一种或几种组成,其中只有M分子同时含有三种元素;W为A、B两元素组成的18电子分子,可作火箭燃料;甲、乙为非金属单质;X分子含有10个电子。它们之间的转化关系如图②所示。
| B | D | |
| | | E |
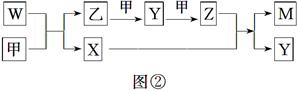
请回答下列问题:
(1)Z的化学式为__________________。
(2)E的单质与水反应的离子方程式为________________________________________。
(3)W空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。W空气燃料电池放电时,正极反应式为________________________________,负极反应式为____________________。
(4)将一定量的A2、B2的混合气体放入1 L密闭容器中,在500 ℃、2×107 Pa下达到平衡。测得平衡气体的总物质的量为0.50 mol,其中A2为0.3 mol,B2为0.1 mol。则该条件下A2的平衡转化率为________,该温度下的平衡常数为____________(结果保留3位有效数字)。