题目内容
将l00mL 0.1mol/L的BaCl2溶液与50mL 0.2mol/L的NaCl溶液混合(不考虑体积变化),则混合溶液中氯离子的物质的量浓度是( )
| A、0.2mol/L | B、0.01mol/L | C、0.lmol/L | D、0.02mol/L |
分析:先利用n=cV计算氯化钠、氯化钡的物质的量,再计算氯离子的总物质的量和溶液的体积,根据c=
来计算混合溶液中Cl-物质的量浓度.
| n |
| V |
解答:解:n(BaCl2)=0.1 mol/L×0.1 L=0.01 mol,
n(NaCl)=0.2mol/L×0.05L=0.01 mol,
则混合后Cl-离子总的物质的量=0.01mol×2+0.01mol=0.03mol,
混合后总体积=100mL+50mL=150mL=0.15L,
则混合溶液中Cl-物质的量浓度为
=0.2mol/L,
故选A.
n(NaCl)=0.2mol/L×0.05L=0.01 mol,
则混合后Cl-离子总的物质的量=0.01mol×2+0.01mol=0.03mol,
混合后总体积=100mL+50mL=150mL=0.15L,
则混合溶液中Cl-物质的量浓度为
| 0.03mol |
| 0.15L |
故选A.
点评:本题考查物质的量浓度有关计算,比较基础,确定混合后氯离子总物质的量是关键,注意对公式的理解与灵活应用.

练习册系列答案
相关题目
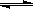 CH3OH(g);CO的转化率与温度、压强的关系如图所示。
CH3OH(g);CO的转化率与温度、压强的关系如图所示。
 Ag+(aq)+Cl-(aq)。25oC时,现将足量AgCl分别放入:①l00mL蒸馏水;②l0 0mL 0.2 mol?L-1AgNO3溶液;③100mL 0.1 mol?L-1氯化镁溶液;④100mL 0.1 mol?L-1氯化钠溶液。充分搅拌后,相同温度下Ag+浓度由大到小的顺序是 (填写序号)。
Ag+(aq)+Cl-(aq)。25oC时,现将足量AgCl分别放入:①l00mL蒸馏水;②l0 0mL 0.2 mol?L-1AgNO3溶液;③100mL 0.1 mol?L-1氯化镁溶液;④100mL 0.1 mol?L-1氯化钠溶液。充分搅拌后,相同温度下Ag+浓度由大到小的顺序是 (填写序号)。

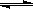 CH3OH(g);CO的转化率与温度、压强的关系如图所示。
CH3OH(g);CO的转化率与温度、压强的关系如图所示。
 Ag+(aq)+Cl-(aq)。25oC时,现将足量AgCl分别放入:①l00mL蒸馏水;②l0 0mL 0.2 mol?L-1AgNO3溶液;③100mL 0.1 mol?L-1氯化镁溶液;④100mL 0.1 mol?L-1氯化钠溶液。充分搅拌后,相同温度下Ag+浓度由大到小的顺序是 (填写序号)。
Ag+(aq)+Cl-(aq)。25oC时,现将足量AgCl分别放入:①l00mL蒸馏水;②l0 0mL 0.2 mol?L-1AgNO3溶液;③100mL 0.1 mol?L-1氯化镁溶液;④100mL 0.1 mol?L-1氯化钠溶液。充分搅拌后,相同温度下Ag+浓度由大到小的顺序是 (填写序号)。 Ag+(aq)+Cl-(aq), 在25℃时,AgCl的Ksp=1.8×10-10
Ag+(aq)+Cl-(aq), 在25℃时,AgCl的Ksp=1.8×10-10