题目内容
【题目】合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g)+3H2(g)![]() 2NH3(g)(正反应为放热反应),673 K、30 MPa下,n(NH3)和n(H2)随时间t变化的关系示意图如图所示。下列叙述中正确的是( )
2NH3(g)(正反应为放热反应),673 K、30 MPa下,n(NH3)和n(H2)随时间t变化的关系示意图如图所示。下列叙述中正确的是( )
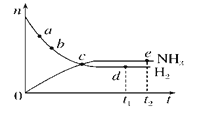
A. c点处正反应速率和逆反应速率相等
B. a点处正反应速率比b点处的大
C. d点(t1时刻)和e点(t2时刻)处n(N2)不同
D. t2时刻,正反应速率大于逆反应速率
【答案】B
【解析】试题分析:A. c点处氨气与氢气的物质的量相等,而不是正反应速率和逆反应速率相等,错误;B. a点处由于氢气的浓度大于b点,所以正反应速率比b点处的大,正确;C. d点(t1时刻)和e点(t2时刻)处处于同一条件下的同一平衡状态,所以n(N2)相同,错误;D. t2时刻,反应处于平衡状态,正反应速率等于逆反应速率,错误。

 一线名师权威作业本系列答案
一线名师权威作业本系列答案【题目】研究含氮化合物对能源、环保和生产具有重要的意义。请回答下列问题:
(1)在2 L密闭容器内, 800 ℃时反应2NO(g)+O2(g) ![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
①如图所示A点处v正___(填“>”、“<”或“=”,下同)v逆,A点处v正___B点处v正。
②如图所示的曲线,其中表示NO2的变化的曲线是________(填a、b、c、d等字母)。用O2表示2 s内该反应的速率v=________。
(2)已知化学反应N2+3H2![]() 2NH3的能量变化如图所示,
2NH3的能量变化如图所示,
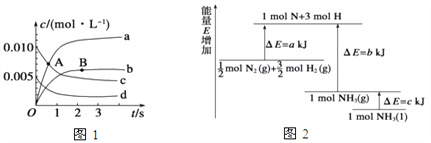
则,1 mol N和3 mol H生成1 mol NH3(g)是______能量的过程(填“吸收”或“释放”),由![]() mol N2(g)和
mol N2(g)和![]() mol H2(g)生成1 mol NH3(g)过程________(填“吸收”或“释放”)_______kJ能量(用含字母a、b、c的关系式表达)。
mol H2(g)生成1 mol NH3(g)过程________(填“吸收”或“释放”)_______kJ能量(用含字母a、b、c的关系式表达)。