题目内容
根据题目要求,回答下列问题
(1)①配平该化学方程式:
KClO3+ HCl(浓)= KCl+ ClO2↑+ Cl2↑+ H20
②KClO3和Cl2都有很强的氧化性,均能将电镀废水中的CN-氧化为无毒的物质,自身被还原为Cl-.处理含CN-相同量得电镀废水,所需Cl2的物质的量是KClO3的 倍.
(2)工业上用铝粉还原一些金属氧化物,这类反应称为铝热反应.写出在高温下铝还原氧化铁的化学方程式 ,在反应中消耗2mol铝,则转移了 mol电子
(3)印刷电路板是由塑料和铜箔复合而成,刻制印刷电路时要用FeCl3溶液作为“腐蚀液”溶解铜. ①写出该反应的化学方程式:
②使用过的腐蚀液会失效,但还可以回收利用,其中有一步需要将Fe2+转化为Fe3+,下列试剂能实现上述变化的是 (此空有两个答案,填序号)
A.氯气 B.铁 C.双氧水 D.稀硫酸
(4)写出下列反应的化学方程式:
①氯化铝与氨水作用制备氢氧化铝:
②用氢氧化铝治疗胃酸过多:
③向Na2SiO3溶液中通入少量CO2反应:
④镁条着火时,不能用液态CO2灭火剂来灭火的原因:
(5)在宇宙飞船中,为了使宇航员得到良好的生存环境,一般在飞船机内安装了盛有Na2O2颗粒的装置,它的用途是再生O2,如果用KO2代替Na2O2也能达到同样的目的,反应产物也很相似.写出KO2与CO2反应的化学方程式 .
(1)①配平该化学方程式:
②KClO3和Cl2都有很强的氧化性,均能将电镀废水中的CN-氧化为无毒的物质,自身被还原为Cl-.处理含CN-相同量得电镀废水,所需Cl2的物质的量是KClO3的
(2)工业上用铝粉还原一些金属氧化物,这类反应称为铝热反应.写出在高温下铝还原氧化铁的化学方程式
(3)印刷电路板是由塑料和铜箔复合而成,刻制印刷电路时要用FeCl3溶液作为“腐蚀液”溶解铜. ①写出该反应的化学方程式:
②使用过的腐蚀液会失效,但还可以回收利用,其中有一步需要将Fe2+转化为Fe3+,下列试剂能实现上述变化的是
A.氯气 B.铁 C.双氧水 D.稀硫酸
(4)写出下列反应的化学方程式:
①氯化铝与氨水作用制备氢氧化铝:
②用氢氧化铝治疗胃酸过多:
③向Na2SiO3溶液中通入少量CO2反应:
④镁条着火时,不能用液态CO2灭火剂来灭火的原因:
(5)在宇宙飞船中,为了使宇航员得到良好的生存环境,一般在飞船机内安装了盛有Na2O2颗粒的装置,它的用途是再生O2,如果用KO2代替Na2O2也能达到同样的目的,反应产物也很相似.写出KO2与CO2反应的化学方程式
考点:镁、铝的重要化合物,氧化还原反应方程式的配平,铁盐和亚铁盐的相互转变
专题:氧化还原反应专题,几种重要的金属及其化合物
分析:(1)①KClO3中氯元素化合价由+5价降低为ClO2中+4价,化合价降低1价;HCl中氯元素化合价由-1价升高为Cl2中0价,化合价升高2价,化合价升降最小公倍数为2,故ClO2系数为2,Cl2系数为1;再结合原子守恒,配平各物质的系数;
②每摩尔Cl2得到2mol电子,而每摩尔KClO3得到6mol电子,故为3倍;
(2)在高温下铝还原Fe2O3 生成Al2O3和Fe,根据反应的化学方程式计算转移电子的物质的量;
(3)①反应为Cu和FeCl3,生成物为CuCl2和FeCl2,
②将Fe2+转化为Fe3+,需要加氧化剂;
(4)①氨水碱性较弱,氯化铝和氨水反应生成氢氧化铝沉淀和氯化铵;
②氢氧化铝与HCl反应生成氯化铝和水;
③硅酸钠与少量二氧化碳反应生成硅酸沉淀和碳酸钠;
④镁与二氧化碳反应生成碳和氧化镁;
(5)根据题意可知,KO2与CO2反应生成碳酸钾和氧气,以此书写反应的化学方程式.
②每摩尔Cl2得到2mol电子,而每摩尔KClO3得到6mol电子,故为3倍;
(2)在高温下铝还原Fe2O3 生成Al2O3和Fe,根据反应的化学方程式计算转移电子的物质的量;
(3)①反应为Cu和FeCl3,生成物为CuCl2和FeCl2,
②将Fe2+转化为Fe3+,需要加氧化剂;
(4)①氨水碱性较弱,氯化铝和氨水反应生成氢氧化铝沉淀和氯化铵;
②氢氧化铝与HCl反应生成氯化铝和水;
③硅酸钠与少量二氧化碳反应生成硅酸沉淀和碳酸钠;
④镁与二氧化碳反应生成碳和氧化镁;
(5)根据题意可知,KO2与CO2反应生成碳酸钾和氧气,以此书写反应的化学方程式.
解答:
解:(1)①KClO3中氯元素化合价由+5价降低为ClO2中+4价,化合价降低1价;HCl中氯元素化合价由-1价升高为Cl2中0价,化合价升高2价,化合价升降最小公倍数为2,故ClO2系数为2,Cl2系数为1;所以KClO3系数为2,KCl系数为2,HCl系数为4,结合原子守恒配平方程式,其反应方程式为:
2KClO3+4HCl(浓)=2KCl+2ClO2↑+Cl2↑+2H2O,
故答案为:2;4;2;2;1;2;
②依据电子守恒分析计算,每摩尔Cl2得到2mol电子,而每摩尔KClO3得到6mol电子,则所需Cl2的物质的量是KClO3的3倍,故答案为:3;
(2)在高温下铝还原Fe2O3 生成Al2O3和Fe,则反应的方程式为:Fe2O3+2Al
Al2O3+2Fe;因反应中Al的化合价由0价升高到+3价,则消耗了2mol铝,则转移电子的物质的量为2mol×3=6mol;
故答案为:Fe2O3+2Al
Al2O3+2Fe;6;
(3)①反应为Cu和FeCl3,生成物为CuCl2和FeCl2,则反应的方程式为:Cu+2FeCl3=CuCl2+2FeCl2 ;
故答案为:Cu+2FeCl3=CuCl2+2FeCl2 ;
②将Fe2+转化为Fe3+,需要加氧化剂,所以可以选择氯气和双氧水;
故答案为:AC;
(4)①氨水碱性较弱,氯化铝和氨水反应生成氢氧化铝沉淀和氯化铵,反应的方程式为:AlCl3+3NH3?H2O=Al(OH)3↓+3NH4Cl,
故答案为:AlCl3+3NH3?H2O=Al(OH)3↓+3NH4Cl;
②氢氧化铝与HCl反应生成氯化铝和水,反应的方程式为:Al(OH)3+3HCl=AlCl3+3H2O,故答案为:Al(OH)3+3HCl=AlCl3+3H2O;
③硅酸钠与少量二氧化碳反应生成硅酸沉淀和碳酸钠,反应的方程式为:Na2SiO3+H2O+CO2=H2SiO3↓+Na2CO3;
故答案为:Na2SiO3+H2O+CO2=H2SiO3↓+Na2CO3;
④镁与二氧化碳反应生成碳和氧化镁,所以镁条着火时,不能用液态CO2灭火剂来灭火,其反应的热化学方程式为:2Mg+CO2
2MgO+C;
故答案为:2Mg+CO2
2MgO+C;
(5)根据题意可知,“用KO2代替Na2O2也能达到同样的目的,反应产物也很相似”,
则KO2与CO2反应生成碳酸钾和氧气,反应的方程式为4KO2+2CO2=2K2CO3+3O2,
故答案为:4KO2+2CO2=2K2CO3+3O2.
2KClO3+4HCl(浓)=2KCl+2ClO2↑+Cl2↑+2H2O,
故答案为:2;4;2;2;1;2;
②依据电子守恒分析计算,每摩尔Cl2得到2mol电子,而每摩尔KClO3得到6mol电子,则所需Cl2的物质的量是KClO3的3倍,故答案为:3;
(2)在高温下铝还原Fe2O3 生成Al2O3和Fe,则反应的方程式为:Fe2O3+2Al
| ||
故答案为:Fe2O3+2Al
| ||
(3)①反应为Cu和FeCl3,生成物为CuCl2和FeCl2,则反应的方程式为:Cu+2FeCl3=CuCl2+2FeCl2 ;
故答案为:Cu+2FeCl3=CuCl2+2FeCl2 ;
②将Fe2+转化为Fe3+,需要加氧化剂,所以可以选择氯气和双氧水;
故答案为:AC;
(4)①氨水碱性较弱,氯化铝和氨水反应生成氢氧化铝沉淀和氯化铵,反应的方程式为:AlCl3+3NH3?H2O=Al(OH)3↓+3NH4Cl,
故答案为:AlCl3+3NH3?H2O=Al(OH)3↓+3NH4Cl;
②氢氧化铝与HCl反应生成氯化铝和水,反应的方程式为:Al(OH)3+3HCl=AlCl3+3H2O,故答案为:Al(OH)3+3HCl=AlCl3+3H2O;
③硅酸钠与少量二氧化碳反应生成硅酸沉淀和碳酸钠,反应的方程式为:Na2SiO3+H2O+CO2=H2SiO3↓+Na2CO3;
故答案为:Na2SiO3+H2O+CO2=H2SiO3↓+Na2CO3;
④镁与二氧化碳反应生成碳和氧化镁,所以镁条着火时,不能用液态CO2灭火剂来灭火,其反应的热化学方程式为:2Mg+CO2
| ||
故答案为:2Mg+CO2
| ||
(5)根据题意可知,“用KO2代替Na2O2也能达到同样的目的,反应产物也很相似”,
则KO2与CO2反应生成碳酸钾和氧气,反应的方程式为4KO2+2CO2=2K2CO3+3O2,
故答案为:4KO2+2CO2=2K2CO3+3O2.
点评:本题考查了氧化还原反应、方程式的配平、方程式的书写等,题目涉及的知识点较多,侧重于基础知识的综合应用的考查,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
容量瓶上需标有以下五项中的( )①温度;②浓度;③容量;④压强;⑤刻度线.
| A、①③⑤ | B、③⑤ |
| C、①②④ | D、②④ |
在酸性溶液中能大量共存,并且溶液为无色透明的是( )
| A、Na+、K+、Cu2+、SO42- |
| B、NH4+、Na+、NO3-、Cl- |
| C、K+、Ca2+、HCO3-、Cl- |
| D、Mg2+、Na+、Cl-、OH- |
燃料电池是燃料(如CO、H2、CH4等)跟O2(或空气)反应,将化学能转化为电能的装置,电解质溶液是强碱溶液.下列关于CH4燃料电池的说法正确的是( )
| A、放电时溶液中的阴离子向正极移动 |
| B、负极反应式为:CH4+10OH--8e-=CO32-+7H2O |
| C、随着放电的进行,溶液的pH不变 |
| D、负极反应式为:O2+2H2O+4e=4OH- |
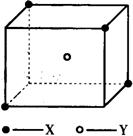 某离子晶体晶胞结构如图所示,x位于立方体的顶点,Y位于立方体中心.试分析:
某离子晶体晶胞结构如图所示,x位于立方体的顶点,Y位于立方体中心.试分析: