题目内容
镁在空气中完全燃烧,将其产物完全溶于50mL1.8mol/L盐酸中,有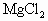 和
和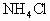 生成.再加入20mL0.9mol/LNaOH溶液恰好中和过量的盐酸.此时又加入过量NaOH溶液,并使生成的氨全部蒸出,经测定
生成.再加入20mL0.9mol/LNaOH溶液恰好中和过量的盐酸.此时又加入过量NaOH溶液,并使生成的氨全部蒸出,经测定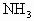 共0.102g,试计算原来镁的质量.
共0.102g,试计算原来镁的质量.
答案:
解析:
提示:
解析:
|
所以n( 解题过程中,注意利用 |
提示:
|
按题意,加入过量NaOH溶液前,所用盐酸中的 |

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
下列反应中,有1mol电子转移的是
[ ]
A.11.5g金属钠在过量氯气中完全燃烧
B.0.125mol二氧化锰与浓盐酸完全反应
C.标准状态下5.6L氯气与钠完全反应
D.12g镁在空气中完全燃烧
 有:1.8×0.05-0.02×0.9-
有:1.8×0.05-0.02×0.9- =0.066(mol)
=0.066(mol) )为0.033mol,Mg的质量为24×0.033=0.792(g)
)为0.033mol,Mg的质量为24×0.033=0.792(g) 的物质的量守恒这一关系.
的物质的量守恒这一关系. 分别转化到
分别转化到 、
、 和NaCl中,盐酸的物质的量可求知,
和NaCl中,盐酸的物质的量可求知, 的物质的量可从0.102g氨推算,中和过量盐酸用去NaOH的物质的量可由题中已知数据求出(即此时NaCl的物质的量).这样便能计算
的物质的量可从0.102g氨推算,中和过量盐酸用去NaOH的物质的量可由题中已知数据求出(即此时NaCl的物质的量).这样便能计算 中
中 的物质的量,再由此求出Mg的质量.
的物质的量,再由此求出Mg的质量.