题目内容
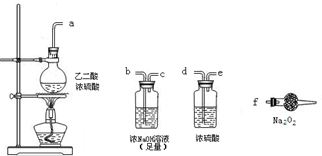
标准状况下,7.84mL CO2和O2混合气,通过足量Na2O2充分反应,再将剩余气体慢慢通入倒扣在水中且充有8.96mL的NO试管中,边通边振荡,当通完后,试管中恰好充满液体,计算:
(1)CO2的体积。
(2)设溶液的体积为20mL,计算所得硝酸物质的量浓度。
答案:
解析:
解析:
解:根据题目提供的数据逆向推导。首先根据NO的体积,可以计算出通入的O2的体积,再根据O2与原混合气的体积之差求出与Na2O2反应的CO2的体积;最后根据NO与HNO3物质的量相等,求HNO3的浓度。 (1)根据化学反应方程式: 4NO + 3O2+2H2O═4HNO3 4 3 8.96mL V(O2) V(O2)=6.72mL 再由2Na2O2+2CO2═2Na2CO3+O2 DV 2 1 V(CO2) (7.84-6.72)mL V(CO2)=2.24mL (2)最后由4NO+3O2+2H2O═4HNO3 4 4 n(HNO3)=0.0004mol c(HNO3)=
|

练习册系列答案
相关题目