题目内容
6.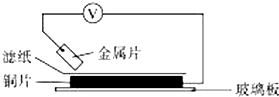 将洁净的金属片A、B、C、D分别放置在浸有某种盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如下表.已知,构成两电极的金属其金属活泼性相差越大,电压表的读数越大.请依据记录数据判断,下列有关说法正确的是( )
将洁净的金属片A、B、C、D分别放置在浸有某种盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如下表.已知,构成两电极的金属其金属活泼性相差越大,电压表的读数越大.请依据记录数据判断,下列有关说法正确的是( )| 金属 | 电子流动方向 | 电压/V |
| A | A→Cu | +0.78 |
| B | Cu→B | +0.15 |
| C | C→Cu | +1.35 |
| D | D→Cu | +0.30 |
| A. | 在四种金属中C的还原性最弱 | |
| B. | 金属B能从硫酸铜溶液中置换出铜 | |
| C. | AD若形成原电池时A为正极 | |
| D. | AB形成合金时,将该合金露置在空气中,A先被腐蚀 |
分析 形成原电池反应时,活泼金属为负极,电子由负极经外电路流向正极,由电子流向可知A、C、D的活泼性比Cu强,B的活泼性比Cu弱,由题给信息“构成两电极的金属其金属活泼性相差越大,电压表的读数越大”可知活泼性为C>A>D>Cu>B,以此解答.
解答 解:由电子流向可知A、C、D的活泼性比Cu强,B的活泼性比Cu弱,由题给信息“构成两电极的金属其金属活泼性相差越大,电压表的读数越大”可知活泼性为C>A>D>Cu>B,
A.在四种金属中C的还原性最强,故A错误;
B.活泼性铜大于B,则金属铜能置换出B,故B错误;
C.AD若形成原电池时,A为负极,D为正极,故C错误;
D.活泼性A大于B,则A、B形成合金时,将该合金露置在空气中,A先被腐蚀,故D正确.
故选D.
点评 本题考查原电池知识,侧重于学生的分析能力的考查,为高考高频考点,注意根据题给信息解答该题,仔细审题,加强审题能力的培养,把握金属的活泼性强弱,为解答该题的关键,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.能在水溶液中大量共存的一组离子是( )
| A. | Fe2+、Mg2+、SO42-、NO3- | B. | Na+、Ag+、Br-、PO43- | ||
| C. | Ba2+、K+、SO32-、ClO- | D. | Al3+、NH4+、CO32-、Cl- |
17.下列各组离子能大量共存的是( )?
| A. | K+、NH4+、SO42-、NO3- | B. | OH-、K+、NH4+、Cl- | ||
| C. | Fe3+、Cl-、Na+、OH- | D. | Fe2+、H+、SO32-、NO3- |
14.对于以下反应:A(s)+3B(g)?2C(g)+D(g),在一定温度和容积固定的容器中,下列判断正确的是( )
| A. | 若反应是放热反应,升高温度,正反应速率增大 | |
| B. | 往容器中通入稀有气体He,由于压强增大,所以反应速率增大 | |
| C. | 往容器中加入少量A,反应速率增大 | |
| D. | 当容器内的压强不再变化,可以判断反应已经达到平衡 |
1.黄铁矿石的主要成分为FeS2(含少量FeS,假设其他杂志中不含Fe、S元素.且高温下不发生化学变化),是我国大多数硫酸厂制取硫酸钠主要材料,某化学兴趣小组对该黄铁矿石进行如下实验探究.
将m1g该黄铁矿石的样品放入如下图装置(夹持和加热装置略)的石英管中,从a处不断地缓缓通入空气,高温灼烧黄铁矿样品至反应完全,得到红棕色固体和一种刺激性气味的气体.

【实验一】测定硫元素的含量
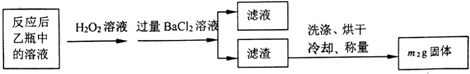
(1)甲装置的作用是除去空气中的二氧化碳,使装置乙中的溶液只吸收黄铁矿煅烧产生的二氧化硫;鼓入空气的作用是提供反应物氧气,排除装置中生成的二氧化硫,使二氧化硫完全被乙吸收.
(2)反应结束后乙瓶中的溶液需加足量H2O2溶液的目的是Na2SO3+H2O2=Na2SO4+H2O (用化学方程式表示).
(3)该黄铁矿石中硫元素的质量分数为$\frac{32{m}_{2}}{233{m}_{1}}$×100%(列出表达式即可).
【实验二】测定铁元素的含量
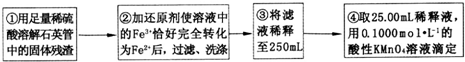
(4)②中,若用铁粉作还原剂,则所测得的铁元素的含量偏大 (填“偏大”、“偏小”或“无影响”).
(5)③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有250mL容量瓶.
(6)④中测定时,标准KMnO4溶液应装入酸式式滴定管,滴定至终点的实验现象为:最后一滴高锰酸钾溶液滴入时,溶液颜色突变为紫色,且在30s内不变色
(7)某同学一共进行了四次滴定实验,实验结果记录如下:
根据所给数据,计算该稀释液中Fe2+的物质的量浓度为c(Fe2+)=0.500mol/L.
将m1g该黄铁矿石的样品放入如下图装置(夹持和加热装置略)的石英管中,从a处不断地缓缓通入空气,高温灼烧黄铁矿样品至反应完全,得到红棕色固体和一种刺激性气味的气体.

【实验一】测定硫元素的含量

(1)甲装置的作用是除去空气中的二氧化碳,使装置乙中的溶液只吸收黄铁矿煅烧产生的二氧化硫;鼓入空气的作用是提供反应物氧气,排除装置中生成的二氧化硫,使二氧化硫完全被乙吸收.
(2)反应结束后乙瓶中的溶液需加足量H2O2溶液的目的是Na2SO3+H2O2=Na2SO4+H2O (用化学方程式表示).
(3)该黄铁矿石中硫元素的质量分数为$\frac{32{m}_{2}}{233{m}_{1}}$×100%(列出表达式即可).
【实验二】测定铁元素的含量

(4)②中,若用铁粉作还原剂,则所测得的铁元素的含量偏大 (填“偏大”、“偏小”或“无影响”).
(5)③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有250mL容量瓶.
(6)④中测定时,标准KMnO4溶液应装入酸式式滴定管,滴定至终点的实验现象为:最后一滴高锰酸钾溶液滴入时,溶液颜色突变为紫色,且在30s内不变色
(7)某同学一共进行了四次滴定实验,实验结果记录如下:
| 试验次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 消耗KmnO4溶液体积/mL | 25.00 | 25.03 | 20.00 | 24.97 |
11.有核磁共振氢谱如图,下列有机物符合该图谱的是( )
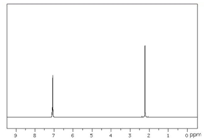

| A. |  | B. | 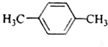 | C. | 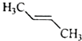 | D. | 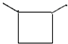 |
16.下列说法正确的是( )
| A. | 原子的原子序数越大,原子半径越大 | |
| B. | 同族元素相差的原子序数可能为16、26、36、46 | |
| C. | I A族与ⅦA族元素间可形成共价化合物或离子化合物 | |
| D. | 碱金属单质的熔点、沸点均随着原子序数的递增而升高 |