题目内容
取25.0 g CuSO4·5H2O晶体,加热使之均匀缓慢升温至1 000 ℃,并恒温1小时,将带火星的木条插入产生的气体中,木条可以复燃。试通过计算回答下列问题。(已知:在1 000 ℃时,Cu+比Cu2+稳定)。以下是加热过程中发生的化学反应:
CuSO4·5H2O![]() CuSO4+5H2O↑
CuSO4+5H2O↑
CuSO4![]() CuO+SO3↑ 4CuO
CuO+SO3↑ 4CuO![]() 2Cu2O+O2↑
2Cu2O+O2↑
2SO3![]() 2SO2+O2
2SO2+O2
(1)充分反应后,最终固体产物颜色为____________,其质量为_________g。
(2)在某中间温度时,固体产物质量能否为10 g?_________(填“能”或“不能”)。如可能,请计算其组成和质量,如不可能,请说明理由___________________________________。
(3)如果某同学在做此实验时,最后得到固体质量为7.6 g,试计算该固体的组成和质量。
(4)不考虑实验带来的误差,在该反应条件下最终生成气态产物除去水后,物质的量可能为_________。
A.0.10 mol B.0.15 mol C.0.20 mol
(1)红色 7.2
(2)能,产物中有CuO 6 g,CuSO4 4 g
(3)Cu2O 3.6 g CuO 4 g
(4)B
解析:(1)2CuSO4·5H2O—Cu2O
2×250 144
25.0 g x
x=7.2 g
(2)若产物全部为CuSO4,则质量为16 g,若产物全部为CuO,则质量为8 g。
所以10 g固体中含有CuSO4和CuO,设CuSO4和CuO的物质的量分别为x、y,
x+y=0.1 mol
160 g·mol·L-1x+80 g·mol·L-1y=10 g
解得x=0.025 mol,y=0.075 mol
即CuSO4:4 g,CuO:6 g
(3)若产物全部是CuO,则质量为8 g,若产物全部是Cu2O,则质量为7.2 g,所以7.6 g固体中含有Cu2O和CuO,则有:
2n(Cu2O)+n(CuO)=0.1 mol
144 g·mol·L-1·n(Cu2O)+80 g·mol·L-1n(CuO)=7.6 g
解得n(Cu2O)=0.025 mol,则m(Cu2O)=3.6 g
n(CuO)=0.05 mol,则m(CuO)=4 g

 )+Fe3O4(s) = 4CO2(g)+3Fe(s) △H3=-13.7 kJ·mol—1 ③
)+Fe3O4(s) = 4CO2(g)+3Fe(s) △H3=-13.7 kJ·mol—1 ③ 00℃时,C(s)+CO2(g)
00℃时,C(s)+CO2(g) 2CO(g)的平衡常数K=1.64,相同条件下测得高炉内c(CO)=0.20 mol·L-1、c(CO2)=0.05 mol·L-1,此时反应向_______(填“正”或“逆”)方向进行。
2CO(g)的平衡常数K=1.64,相同条件下测得高炉内c(CO)=0.20 mol·L-1、c(CO2)=0.05 mol·L-1,此时反应向_______(填“正”或“逆”)方向进行。 (g) = CO2(g) △H1=-393.5 kJ·mol—1 ①
(g) = CO2(g) △H1=-393.5 kJ·mol—1 ① 2CO(g)的平衡常数K=1.64,相同条件下测得高炉内c(CO)=0.20mol·L-1、c(CO2)=0.05mol·L-1,此时反应向 ▲ (填“正”或“逆”)方向进行。
2CO(g)的平衡常数K=1.64,相同条件下测得高炉内c(CO)=0.20mol·L-1、c(CO2)=0.05mol·L-1,此时反应向 ▲ (填“正”或“逆”)方向进行。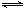 2CO(g)的平衡常数K=1.64,相同条件下测得高炉内c(CO)=0.20 mol·L-1、c(CO2)=0.05 mol·L-1,此时反应向_______(填“正”或“逆”)方向进行。
2CO(g)的平衡常数K=1.64,相同条件下测得高炉内c(CO)=0.20 mol·L-1、c(CO2)=0.05 mol·L-1,此时反应向_______(填“正”或“逆”)方向进行。