题目内容
 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.01 | 0.008 | 0.007 | 0.007 | 0.007 |
放
放
热反应.(2)如图中表示NO2的变化的曲线是
b
b
用O2表示从0~2s内该反应的平均速率v=
0.0015mol/(L?s)
0.0015mol/(L?s)
(3)为使该反应的反应速率增大,且平衡向正反应方向移动的是
c
c
a.及时分离除NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂.
分析:(1)升高温度,平衡向吸热反应方向移动,根据二氧化氮浓度的变化确定反应是吸热反应还是放热反应;
(2)根据一氧化氮物质的量的变化知,该反应向正反应方向移动,则二氧化氮的物质的量在不断增大,且同一时间段内,一氧化氮减少的物质的量等于二氧化氮增加的物质的量;
根据△v=
计算一氧化氮的反应速率,再结合同一化学反应同一时间段内,各物质的反应速率之比等于其计量数之比计算氧气的反应速率;
(3)为使该反应的反应速率增大,可采用增大压强、升高温度、加入催化剂、增大反应物浓度等方法,再结合平衡移动原理分析解答.
(2)根据一氧化氮物质的量的变化知,该反应向正反应方向移动,则二氧化氮的物质的量在不断增大,且同一时间段内,一氧化氮减少的物质的量等于二氧化氮增加的物质的量;
根据△v=
| ||
| △t |
(3)为使该反应的反应速率增大,可采用增大压强、升高温度、加入催化剂、增大反应物浓度等方法,再结合平衡移动原理分析解答.
解答:解:(1)升高温度,平衡向吸热反应方向移动,NO2的浓度减小,则平衡向逆反应方向移动,所以正反应是放热反应,
故答案为:放;
(2)根据一氧化氮物质的量的变化知,该反应向正反应方向移动,则二氧化氮的物质的量在不断增大,且同一时间段内,一氧化氮减少的物质的量等于二氧化氮增加的物质的量,所以表示NO2的变化的曲线是b,
0~2s内v(NO)=
mol/(L.min)=0.0030mol/(L.min),同一化学反应同一时间段内,各物质的反应速率之比等于其计量数之比,所以氧气的反应速率为 0.0015mol/(L?s),
故答案为:b,0.0015mol/(L?s);
(3)a.及时分离除NO2气体平衡向右移动,但反应速率减小,故错误;
b.适当升高温度,反应速率增大但平衡向逆反应方向移动,故错误;
c.增大O2的浓度反应速率增大,且该反应向正反应方向移动,故正确;
d.选择高效催化剂能增大反应速率,但平衡不移动,故错误;
故选c.
故答案为:放;
(2)根据一氧化氮物质的量的变化知,该反应向正反应方向移动,则二氧化氮的物质的量在不断增大,且同一时间段内,一氧化氮减少的物质的量等于二氧化氮增加的物质的量,所以表示NO2的变化的曲线是b,
0~2s内v(NO)=
| ||
| 2 |
故答案为:b,0.0015mol/(L?s);
(3)a.及时分离除NO2气体平衡向右移动,但反应速率减小,故错误;
b.适当升高温度,反应速率增大但平衡向逆反应方向移动,故错误;
c.增大O2的浓度反应速率增大,且该反应向正反应方向移动,故正确;
d.选择高效催化剂能增大反应速率,但平衡不移动,故错误;
故选c.
点评:本题考查了反应热的判断、反应速率的计算、影响反应速率及平衡移动的因素,注意催化剂只改变反应速率,但不影响平衡移动,为易错点.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
一定条件下,使X(g)与Y(g)在2L密闭容器中发生反应生成z(g).温度为TK时,反应过程中X,Y,Z的物质的量变化如图1所示;若保持其他条件不变,温度分别为T,K和T2,K时,Y的体积分数与时间的关系如图2所示.则下列结论正确的是( )
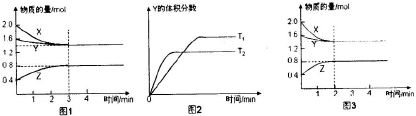

| A、反应进行的前3min内,用X表示的反应速率V(X)=0.1mol/(L?min) | B、平衡时容器内的压强为反应前的0.8倍 | C、保持其他条件不变,升高温度,反应的化学平衡常数K减小 | D、若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强 |
某温度(t℃)时,在2L密闭容器内发生反应:2A (g)+B(g)?2C(g)体系中n(A)随时间的变化如下表:
请回答:
(1)用A浓度变化表示从0~2s内该反应的平均速率v= mol/.
(2)能说明该反应已达到化学平衡状态的是 (填序号).
①容器内压强保持不变 ②A的物质的量保持不变
③容器内密度保持不变 ④消耗2mol A的同时,消耗1mol B
(3)温度升高,A的转化率减小,则该正反应是 (填“吸热”或“放热”)反应.
(4)若开始时充入B的物质的量是A的一半,则t℃时平衡常数K的数值是 .
| 时间/s | 1 | 2 | 3 | 4 | |
| n(A)/mol | 2.0 | 1.0 | 0.8 | 0.8 | 0.8 |
(1)用A浓度变化表示从0~2s内该反应的平均速率v= mol/.
(2)能说明该反应已达到化学平衡状态的是 (填序号).
①容器内压强保持不变 ②A的物质的量保持不变
③容器内密度保持不变 ④消耗2mol A的同时,消耗1mol B
(3)温度升高,A的转化率减小,则该正反应是 (填“吸热”或“放热”)反应.
(4)若开始时充入B的物质的量是A的一半,则t℃时平衡常数K的数值是 .