题目内容
【题目】元素铜在溶液中主要以[Cu(H2O)4]2+(天蓝色)、[Cu(OH)4]2-(蓝色)、[CuCl2]-、 [Cu(NH3)4]2+(深蓝色)等形式存在。CuCl为难溶于水的白色固体。回答下列问题:
(1)在浓的强碱溶液中,Cu2+与Al3+的化学性质相似。在少量的CuSO4溶液中,逐渐加入浓的NaOH溶液直至过量,可观察到的现象是_____________________。
(2)CuCl溶于浓盐酸时发生的反应为CuCl+HCl![]() H[CuCl2],要从H[CuCl2]溶液中析出沉淀的方法是___________________。在热的CuCl2溶液中加入铜粉,可制得CuCl,其反应的离子方程式为___________________,但实际上该反应较难持续进行,其原因是____________________,使反应彻底进行的操作是___________________。
H[CuCl2],要从H[CuCl2]溶液中析出沉淀的方法是___________________。在热的CuCl2溶液中加入铜粉,可制得CuCl,其反应的离子方程式为___________________,但实际上该反应较难持续进行,其原因是____________________,使反应彻底进行的操作是___________________。
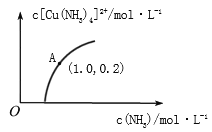
(3)[Cu(H2O)4]2+和[Cu(NH3)4]2+在溶液中可以相互转化。:t℃时,初始浓度为1molL-1的CuSO4溶液中{ Cu2+实际以[Cu(H2O)4]2+的形式存在},[Cu(NH3)4]2+的浓度随氨水浓度[c(NH3)]的变化如图所示
①CuSO4溶液与过量氨水发生反应的总的离子方程式为________________。
②由图可知,溶液的酸性增大,[Cu(H2O)4]2+ 转化为[Cu(NH3)4]2+的平衡转化率___________(填“增大”“减小”或“不变”)。根据A点数据,计算出该温度下的平衡常数K=__________。
③升高温度,溶液中[Cu(H2O)4]2+的平衡转化率减小,则该反应的ΔH_____(填“>”“<”或“=”)0
④硫酸四氯合铜{[Cu(NH3)4]SO4}在碱性镀铜工艺中常用作电镀液的主要成分,电镀时,要控制局部温度不得高于150℃,可能的原因是_______________。电解时。阴极的电极反应式为___________________。
【答案】溶液天蓝色逐渐褪去,同时有蓝色絮状沉淀生成,然后沉淀逐渐溶解形成蓝色溶液加水稀释Cu2++2Cl-+Cu![]() 2CuCl生成的难溶盐CuCl附着在Cu粉的表面,影响反应的继续进行加入浓盐酸使CuCl溶解生成[CuCl2]-[Cu(H2O)4]2++4NH3
2CuCl生成的难溶盐CuCl附着在Cu粉的表面,影响反应的继续进行加入浓盐酸使CuCl溶解生成[CuCl2]-[Cu(H2O)4]2++4NH3![]() [Cu(NH3)4]2++4H2O(或[Cu(H2O)4]2++4NH3·H2O
[Cu(NH3)4]2++4H2O(或[Cu(H2O)4]2++4NH3·H2O![]() [Cu(NH3)4]2++8H2O)减小0.25<超过150℃,[Cu(NH3)4]SO4易分解[Cu(NH3)4]2++2e-=Cu↓+4NH3
[Cu(NH3)4]2++8H2O)减小0.25<超过150℃,[Cu(NH3)4]SO4易分解[Cu(NH3)4]2++2e-=Cu↓+4NH3
【解析】(1)由于Cu2+与Al3+的化学性质相似,在CuSO4溶液中逐滴加入NaOH溶液后,先生成蓝色Cu(OH)2沉淀:Cu2++2OH-=Cu(OH)2↓,继续滴加氢氧化钠溶液,蓝色Cu(OH)2沉淀溶解,而由于此反应时非氧化还原反应,故铜元素的化合价不变,即蓝色Cu(OH)2沉淀溶解后应得到蓝色溶液;
(2)加水稀释,平衡CuCl+HCl![]() H[CuCl2]逆向移动,有CuCl沉淀析出,注意如果滴加NaOH溶液,平衡也会逆向移动,但会生成Cu2O沉淀;
H[CuCl2]逆向移动,有CuCl沉淀析出,注意如果滴加NaOH溶液,平衡也会逆向移动,但会生成Cu2O沉淀;
在热的CuCl2溶液中加入铜粉生成CuCl的离子方程式为Cu2++2Cl-+Cu![]() 2CuCl,但由于生成的难溶盐CuCl附着在Cu粉的表面,阻止反应的继续进行,故实际该反应较难持续进行;为使反应彻底进行可加入浓盐酸使生成的CuCl溶解生成[CuCl2]-;
2CuCl,但由于生成的难溶盐CuCl附着在Cu粉的表面,阻止反应的继续进行,故实际该反应较难持续进行;为使反应彻底进行可加入浓盐酸使生成的CuCl溶解生成[CuCl2]-;
(3)①CuSO4溶液与过量氨水生成[Cu(NH3)4]2+的离子方程式为Cu(H2O)4]2++4NH3·H2O![]() [Cu(NH3)4]2++8H2O;
[Cu(NH3)4]2++8H2O;
②由图可知,溶液的酸性增大,NH3·H2O+H+=NH4++H2O,则平衡逆向移动,[Cu(H2O)4]2+ 转化为[Cu(NH3)4]2+的平衡转化率减小;A点[Cu(NH3)4]2+的浓度为0.2mol/L,则消耗的Cu(H2O)4]2+的浓度为0.2mol/L,则溶液中的c(Cu(H2O)4]2+)=1.0mol/L-0.2mol/L=0.8mol/L,NH3浓度为1.0mol/L,此时该转化反应的平衡常数为 K=![]() =0.25;
=0.25;
③升高温度,溶液中[Cu(H2O)4]2+的平衡转化率减小,说明升温平衡逆向移动,正方向为放热反应,即该反应的ΔH<0;
④温度高于150℃时硫酸四氯合铜易分解,则电镀时,要控制局部温度不得高于150℃;电解时,阴极发生的还原反应的电极反应式为[Cu(NH3)4]2++2e-=Cu↓+4NH3。

 名校课堂系列答案
名校课堂系列答案