题目内容
下列变化能够实现的是
①弱酸与盐溶液反应生成强酸 ②两种氧化物发生反应有气体生成
③两种酸的溶液充分反应后溶液呈中性 ④复分解反应中既没有生成水,也没有生成沉淀和气体
| A.①③ | B.②④ | C.①②④ | D.①②③④ |
D
解析试题分析:①弱酸与盐溶液反应生成强酸,如硫化氢与硫酸铜溶液; ②两种氧化物发生反应有气体生成,如过氧化钠与二氧化碳反应生成氧气;③两种酸的溶液充分反应后溶液呈中性,盐酸与氢氧化钠等物质的量混合; ④如盐酸与次氯酸钠。故选D.
考点:本题考查了复分解反应中物质的类别特点。

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
下列有关实验操作的叙述正确的是
| 选项 | A | B | C | D |
| 实验 |  |  |  |  |
| 结论 | 能组成ZnCu原电池 | 实验室制取少量的乙酸乙酯 | 白色沉淀 为BaSO3 | 用氯化钠与浓硫酸制取(可加热)、净化、收集氯化氢 |
下列叙述正确的是
A.将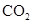 通入 通入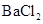 溶液中至饱和,无沉淀产生;再通入 溶液中至饱和,无沉淀产生;再通入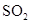 ,产生沉淀 ,产生沉淀 |
B.在稀硫酸中加入铜粉,铜粉不溶解;再加入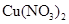 固体,铜粉仍不溶解 固体,铜粉仍不溶解 |
C.向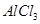 溶液中滴加氨水,产生白色沉淀;再加入过量 溶液中滴加氨水,产生白色沉淀;再加入过量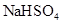 溶液,沉淀消失 溶液,沉淀消失 |
D.纯锌与稀硫酸反应产生氢气的速率较慢;再加入少量 固体,速率不改变 固体,速率不改变 |
有W、X、Y、Z四种物质,其中两种为单质,两种为化合物,且能发生反应:
W+X→Y+Z,则Z不可能是
| A.F2 | B.Si | C.MgO | D.Al2O3 |
关于反应中的先后顺序,下列评价正确的是 ( )
| A.向浓度都为0.1 mol/L 的FeCl3和CuCl2混合溶液加入铁粉,CuCl2首先反应 |
| B.向NH4Al(SO4)2溶液中滴加少量的NaOH溶液,NH4+首先反应 |
| C.向浓度都为0.1 mol/LNa2 CO3和NaOH溶液通入CO2气体,NaOH首先反应 |
| D.向浓度都为0.1 mol/L 的FeCl3加入质量相同、颗粒大小相同的铁和铜,铜先反应 |
下列装置或操作能达到实验目的的是 ( )
I II III IV
| A.实验I:中和热测定 |
| B.实验II:酸性KMnO4溶液中出现气泡,且颜色逐渐褪去 |
| C.实验III:微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色 |
| D.实验IV:可用于HCl气体的吸收 |
下列叙述正确的是
| A.电解氯化镁溶液可获得金属镁 |
| B.将盛满二氧化氮气体的试管倒立在水中,可观察到溶液充满试管 |
| C.为测定熔融氢氧化钠的导电性,可将氢氧化钠固体放在石英坩埚中加热熔化 |
| D.向煤中加入适量石灰石,在煤燃烧时SO2最终生成CaSO4,可减少对大气的污染 |
下列推断正确的是
| A.SiO2是酸性氧化物,不能与任何酸反应 |
| B.Na2CO3、NaHCO3都是盐,都能与CaCl2溶液反应 |
| C.CO、NO都是大气污染气体,在空气中都能稳定存在 |
| D.将SO2通入Ba(ClO)2的溶液中,生成BaSO4沉淀 |