题目内容
【题目】亚硝酸钠是一种工业盐,用途广泛;外观与食盐非常相似,但毒性较强,食品添加亚硝酸钠必须严格控制用量。某化学兴趣小组对食盐与亚硝酸钠进行了如下探究:
㈠鉴别NaCl和NaNO2
(1)测定溶液PH
用PH试纸分别测定0.1mol·L-1两种盐溶液的PH,测得NaNO2溶液呈碱性。NaNO2溶液呈碱性的原因是 ________________________(用离子方程式解释)。NaNO2溶液中c(HNO2)=_____________(用溶液中其它离子的浓度关系式表示)
(2)沉淀法
取2mL0.1 mol·L-1两种盐溶液于试管中,分别滴加几滴稀硝酸银溶液。两只试管均产生白色沉淀。分别滴加几滴稀硝酸并振荡,盛NaNO2溶液的试管中沉淀溶解。
该温度下Ksp(AgNO2)=2×10-8(mol·L-1)2; Ksp(AgCl)=1.8×10-10(mol·L-1)2
则反应AgNO2(s) +Cl-(aq)![]() AgCl(s)+ NO2-(aq)的化学平衡常数K=__________
AgCl(s)+ NO2-(aq)的化学平衡常数K=__________
(3)氧化法
取2mL0.1 mol·L-1两种盐溶液于试管中,分别滴加几滴酸性KMnO4溶液。使酸性KMnO4溶液褪色的是NaNO2溶液。该反应的离子方程式为____________。
㈡NaNO2性质探究
该兴趣小组同学用下图装置探究亚硝酸钠与硫酸反应及气体产物成分。
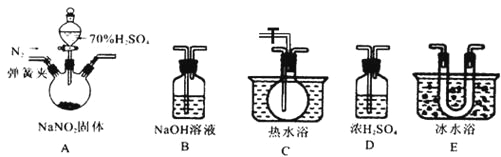
已知: 气体液化的温度:NO221℃ 、 NO –152℃
(1)为了检验装置A中生成的气体产物,仪器的连接顺序为(从左向右连接):A→______→ ______→_______→_______;组装好仪器后,接下来进行的操作是________________。
(2)反应前应打开弹簧夹,先通入一段时间氮气,排除装置中的空气。
(3)在关闭弹簧夹,打开分液漏斗活塞,滴入70%硫酸后,A中产生红棕色气体。
①如何确认A中产生气体是否含有NO _________。(写出实验操作、现象和结论)
②装置E的作用是_______________________。
③若向D中通入过量O2,则装置B中发生反应的化学方程式为____________。
【答案】NO2-+H2O![]() HNO2+OH- c(OH-)-c(H+) 111.1 5NO2-+ 2MnO4-+ 6H+ = 5NO3-+ 2Mn2+ + 3H2O D E C B 检验装置的气密性 打开活塞,向D中通入O2,若出现红棕色气体,证明A中产生气体含有NO ;若无红棕色气体出现,则不含NO 冷凝,使NO2完全液化 4NO2+O2+4NaOH=4NaNO3+2H2O
HNO2+OH- c(OH-)-c(H+) 111.1 5NO2-+ 2MnO4-+ 6H+ = 5NO3-+ 2Mn2+ + 3H2O D E C B 检验装置的气密性 打开活塞,向D中通入O2,若出现红棕色气体,证明A中产生气体含有NO ;若无红棕色气体出现,则不含NO 冷凝,使NO2完全液化 4NO2+O2+4NaOH=4NaNO3+2H2O
【解析】
(一)(1)NaNO2溶液显示碱性,NaNO2说明为强碱弱酸盐,亚硝酸根离子水解导致溶液显示碱性;根据亚硝酸钠溶液中的质子守恒分析;
(2)写出该反应的平衡常数表达式,然后根据Ksp(AgNO2)、Ksp(AgCl)进行计算;
(3)酸性高锰酸钾具有强氧化性,将亚硝酸根离子氧化成硝酸根离子;
(二)(1)根据各部分装置的作用进行连接;
(3)①根据一氧化氮和氧气反应生成红棕色二氧化氮气体判断;
②温度低于二氧化氮液化温度时,二氧化氮变成液态;
③氧气过量,进入B中可理解为先生成硝酸,硝酸再与氢氧化钠反应生成硝酸钠和水。
(一)(1)由于NaNO2溶液显示碱性,说明NaNO2为强碱弱酸盐,NO2-在溶液中存在水解平衡,NO2-+H2O![]() HNO2+OH-;根据亚硝酸钠溶液中的质子守恒可得:c(OH-)=c(HNO2)+c(H+),则c(HNO2)=c(OH-)-c(H+)。
HNO2+OH-;根据亚硝酸钠溶液中的质子守恒可得:c(OH-)=c(HNO2)+c(H+),则c(HNO2)=c(OH-)-c(H+)。
(2)反应AgNO2(s)+Cl-(aq)═AgCl(s)+NO2-(aq)的化学平衡常数K=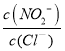 ,根据Ksp(AgCl)=c(Cl-)×c(Ag+)、Ksp(AgNO2)=c(NO2-)×c(Ag+)可知,K=
,根据Ksp(AgCl)=c(Cl-)×c(Ag+)、Ksp(AgNO2)=c(NO2-)×c(Ag+)可知,K= 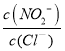 =
=![]() =
=![]() =111.1;
=111.1;
(3)酸性高锰酸钾具有强氧化性,能够将亚硝酸钠氧化成硝酸钠,根据得失电子守恒和原子守恒配平,反应的离子方程式为5NO2-+ 2MnO4-+ 6H+ = 5NO3-+ 2Mn2+ + 3H2O;
(二)(1)C吸收水蒸气,B尾气处理,防止污染空气,D检验NO,E冷却二氧化氮,利用检验NO,所以装置的连接为:A→D→E→C→B;组装好仪器后,接下来进行的操作实验是检查装置气密性。
(3)①确认A中产生气体是否含有NO的方法为:打开活塞,向D中通入O2,若出现红棕色气体,证明A中产生气体含有NO;若无红棕色气体出现,则不含NO。
②二氧化氮的液化温度是21℃,低于此温度时,二氧化氮气体变成液态,所以装置E的作用是冷凝使NO2完全液化。
③如果向D中通入过量O2,则装置B中二氧化氮、氧气和氢氧化钠反应生成硝酸钠和水,其反应方程式为:4NO2+O2+4NaOH=4NaNO3+2H2O。

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案【题目】CO、SO2是大气污染气体,利用化学反应是治理污染的重要方法。
Ⅰ.甲醇可以补充和部分替代石油燃料,缓解能源紧张,利用CO可以合成甲醇:CO+2H2![]() CH3OH(g)。一定条件下,在容积为VL的密闭容器中充入a mol CO与2a mol H2合成甲醇,平衡转化率与温度、压强的关系如图所示。
CH3OH(g)。一定条件下,在容积为VL的密闭容器中充入a mol CO与2a mol H2合成甲醇,平衡转化率与温度、压强的关系如图所示。

(1)下列能说明反应达到平衡状态的是_______(填序号)。
①v逆(CO)=2v正(H2)
②c(CO)=c(CH3OH)
③混合气体的平均相对分子质量不变
④单位时间内生成2n mol H2的同时生成n mol CH3OH
(2)该反应在A点的平衡常数K_________(用a和V表示)。
(3)写出既能增大v(CO)又能提高CO转化率的一项措施:________
Ⅱ.某学习小组以SO2为原料,采用电化学方法制取硫酸。
(4)原电池原理:该小组设计的原理示意图(如图1所示),写出该电池正极的电极反应式_______。

(5)电解原理:该小组用Na2SO3溶液充分吸收SO2得到NaHSO3溶液,然后电解该溶液制得了硫酸(原理如图2所示)。写出开始电解时阳极的电极反应式_______。
Ⅲ.硫代硫酸钠(Na2S2O3)俗称大苏打,有着广泛的用途。用SO2可制Na2S2O3。某小组同学制备、预测并探究硫代硫酸钠的性质(反应均在溶液中进行)。
预测 | 实验操作 | 实验现象 | |
探究1 | Na2S2O3溶液呈碱性 | 把pH试纸放在玻璃片上,用玻璃棒蘸取溶液滴在试纸上 | pH=8 |
探究2 | Na2S2O3具有还原性 | 向新制氯水中滴加Na2S2O3溶液 | 黄绿色颜色变浅,甚至褪去 |
(6)分析SO2能制备Na2S2O3的理论依据是_________。
(7)用离子方程式表示Na2S2O3溶液具有碱性的原因_________。
(8)探究2反应的离子方程式为_________。
【题目】相同温度下,体积均为0.25L的两个恒容密闭容器中发生可逆反应:X2(g) + 3Y2(g) ![]() 2XY3(g) △H=-92.6kJ/mol
2XY3(g) △H=-92.6kJ/mol
实验测得反应在起始、达到平衡时的有关数据如下表所示:
容器 编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
X2 | Y2 | XY3 | ||
① | 1 | 3 | 0 | 23.15 kJ |
② | 0.6 | 1.8 | 0.8 | Q kJ |
下列叙述正确的是
A. 容器①、②中反应的平衡常数不相等
B. 达平衡时,两个容器中XY3的物质的量浓度均为2 mol/L
C. 容器②中反应达到平衡时放出的热量为23.15kJ
D. 若容器①体积为0.20 L,则达平衡时放出的热量小于23.15 kJ