题目内容
6.向溶液中分别通入足量的相应气体后,下列各组离子还能大量存在的是( )| A. | 氯气:K+、Na+、SiO32-、NO3- | B. | 二氧化硫:Na+、NH4+、SO32-、C1- | ||
| C. | 氨气:K+、Na+、AlO2-、CO32- | D. | 乙烯:H+、K+、MnO4-、SO42- |
分析 A.氯气溶于水显示酸性,硅酸根离子与氢离子反应生成硅酸沉淀;
B.二氧化硫与亚硫酸根离子反应生成亚硫酸氢根离子;
C.四种离子之间不反应,通入氨气后也不反应;
D.酸性高锰酸根离子具有强氧化性,能够氧化乙烯.
解答 解:A.通入氯气后,溶液显示酸性,SiO32-与氢离子反应生成硅酸,在溶液中不能大量共存,故A错误;
B.SO32-与通入的二氧化硫反应生成亚硫酸氢根离子,在溶液中不能大量共存,故B错误;
C.K+、Na+、AlO2-、CO32-之间不发生反应,通入氨气后也不反应,在溶液中能够大量共存,故C正确;
D.H+、MnO4-能够氧化乙烯,在溶液中不能大量共存,故D错误;
故选C.
点评 本题考查离子共存的正误判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间等;还应该注意题目限制的条件,试题侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识的能力.

练习册系列答案
相关题目
16.图中I是氢氧燃料电池的示意图,某同学想在II中实现Fe上镀铜,下列说法正确的是( )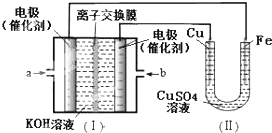

| A. | a处通入O2 | B. | b处发生氧化反应 | ||
| C. | 电流由Cu电极移向b | D. | Fe电极发生的反应为:Cu2++2e-=Cu |
17.下表中对应关系正确的是( )
| A | 甲基橙溶液呈黄色的溶液,一定能大量存在的离子 | Na+、Fe3+、Cl-、SO42- |
| B | 在久置的氯水中能大量共存的微粒 | K+、Al3+、NO3-、HCOOH |
| C | 向明矾溶液中滴加Ba(OH)2溶液,恰好使Al3+沉淀完全: | 2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ |
| D | 1L0.1mol/LCuSO4溶液和足量的Ca充分反应 | 最终生成6.4gCu |
| A. | A | B. | B | C. | C | D. | D |
14.短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T是地壳含量最多的金属元素,W所处的周期序数是其原子最外层电子数的一半.
(1)R的原子结构示意图是 ,用化学方程式表示工业上常用于冶炼T单质的原理是2Al2O3$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑.
,用化学方程式表示工业上常用于冶炼T单质的原理是2Al2O3$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑.
(2)元素的非金属性:Q弱于W(填“强于”或“弱于”),简述其原因是最高价氧化物对应水化物碳酸是弱酸而硫酸是强酸.
(3)元素X与T同周期,且在该周期中原子半径最大,请写出X的最高价氧化物的水化物与T的最高价氧化物的水化物反应的离子方程式OH-+Al(OH)3=AlO2-+2H2O.
| Q | R | ||
| T | W |
 ,用化学方程式表示工业上常用于冶炼T单质的原理是2Al2O3$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑.
,用化学方程式表示工业上常用于冶炼T单质的原理是2Al2O3$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑.(2)元素的非金属性:Q弱于W(填“强于”或“弱于”),简述其原因是最高价氧化物对应水化物碳酸是弱酸而硫酸是强酸.
(3)元素X与T同周期,且在该周期中原子半径最大,请写出X的最高价氧化物的水化物与T的最高价氧化物的水化物反应的离子方程式OH-+Al(OH)3=AlO2-+2H2O.
1.下列说法正确的是( )
| A. | 按系统命名法,化合物  的名称为2,6-二甲基-5-乙基庚烷 的名称为2,6-二甲基-5-乙基庚烷 | |
| B. | 符合分子式为C3H4Cl2的所有同分异构体数目为7种 | |
| C. | 丁烷、正戊烷、新戊烷、已烷的沸点依次升高 | |
| D. | 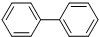 、 、 分别叫做联苯和二苯甲烷,互为同系物,两种分子的所有原子都有可能共平面 分别叫做联苯和二苯甲烷,互为同系物,两种分子的所有原子都有可能共平面 |
15.下列说法中正确的是( )
| A. | ${\;}_{8}^{16}$O、${\;}_{8}^{17}$O、${\;}_{8}^{18}$O互为同素异形体 | |
| B. | O2和O3互为同位素 | |
| C. | CH3-CH2-CH2-CH3与 互为同系物 互为同系物 | |
| D. |  与 与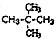 互为同分异构体 互为同分异构体 |
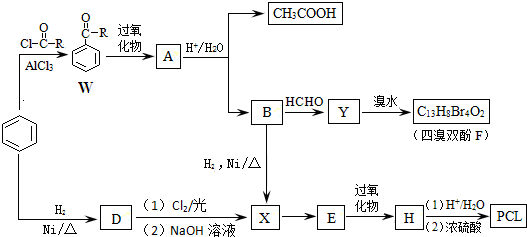
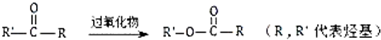
 .
.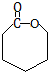 .
. .
. .
. .
. .
.

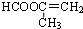 .
.