题目内容
把aL含硫酸铵和硝酸铵的混合液分成两等份,一份需用b mol烧碱刚好把氨全部赶出,另一份与氯化钡溶液反应时,消耗c mol氯化钡,由此可知原溶液中N03-的物质的量浓度是(单位:mol?L-1)
- A.

- B.
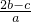
- C.

- D.

D
分析:根据NH4++OH-═NH3+H2O来计算铵根离子的物质的量,利用Ba2++SO42-═BaSO4↓来计算硫酸根离子的物质的量,再根据溶液不显电性来计算原溶液中N03-的物质的量浓度.
解答:设每份中NH4+的物质的量为x,SO42-的物质的量为y,则
NH4++OH-═NH3+H2O
1 1
x b
 ,解得x=b,则每份中NH4+的物质的量为bmol,
,解得x=b,则每份中NH4+的物质的量为bmol,
Ba2++SO42-═BaSO4↓
1 1
c y
 ,解得y=c,则每份中SO42-的物质的量为cmol,
,解得y=c,则每份中SO42-的物质的量为cmol,
由aL含硫酸铵和硝酸铵的混合液分成两等份,
则原溶液中NH4+的物质的量浓度为 mol/L,
mol/L,
原溶液中SO42-的物质的量浓度为 mol/L,
mol/L,
设原溶液中N03-的物质的量浓度为z,
由溶液不显电性,根据电荷守恒可知,
 mol/L×1=
mol/L×1= mol/L×2+z×1,
mol/L×2+z×1,
解得z= mol/L,故选D.
mol/L,故选D.
点评:本题考查学生利用离子方程式的简单计算,明确每份溶液中离子的物质的量与原溶液的关系及原溶液中的电荷守恒即可解答.
分析:根据NH4++OH-═NH3+H2O来计算铵根离子的物质的量,利用Ba2++SO42-═BaSO4↓来计算硫酸根离子的物质的量,再根据溶液不显电性来计算原溶液中N03-的物质的量浓度.
解答:设每份中NH4+的物质的量为x,SO42-的物质的量为y,则
NH4++OH-═NH3+H2O
1 1
x b
 ,解得x=b,则每份中NH4+的物质的量为bmol,
,解得x=b,则每份中NH4+的物质的量为bmol,Ba2++SO42-═BaSO4↓
1 1
c y
 ,解得y=c,则每份中SO42-的物质的量为cmol,
,解得y=c,则每份中SO42-的物质的量为cmol,由aL含硫酸铵和硝酸铵的混合液分成两等份,
则原溶液中NH4+的物质的量浓度为
 mol/L,
mol/L,原溶液中SO42-的物质的量浓度为
 mol/L,
mol/L,设原溶液中N03-的物质的量浓度为z,
由溶液不显电性,根据电荷守恒可知,
 mol/L×1=
mol/L×1= mol/L×2+z×1,
mol/L×2+z×1,解得z=
 mol/L,故选D.
mol/L,故选D.点评:本题考查学生利用离子方程式的简单计算,明确每份溶液中离子的物质的量与原溶液的关系及原溶液中的电荷守恒即可解答.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目