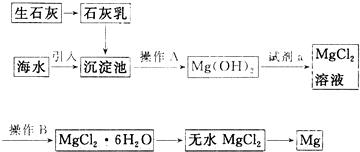
题目内容
11.对于可逆反应4NH3(g)+5O2(g)═4NO(g)+6H2O(g),下列叙述中正确的是( )| A. | 达到化学平衡时v正(O2)=v逆(NO) | |
| B. | 若单位时间内生成xmolNO的同时生成 xmolNH3,则反应达到平衡状态 | |
| C. | 达化学平衡时,若增大容器体积,则正反应速率减小,逆反应速率增大 | |
| D. | 若反应发生在体积恒定的密闭容器中,当密度不变时,化学反应达到平衡状态 |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:A、速率之比不等于计量数之比,故A错误;
B、若单位时间内生成xmolNO等效于消耗x molNH3同时生成x molNH3,正逆反应速率相等,达平衡状态,故B正确;
C、达化学平衡时,若增大容器体积,反应物和生成物的浓度都减小,正逆都减小,故C错误;
D、在体积恒定的密闭容器中,密度始终不变,所以不一定是平衡状态,故D错误;
故选B.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
2.某高分子化合物含有如下结构片段,对此结构的分析正确的是( )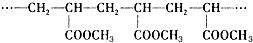
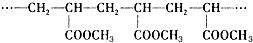
| A. | 它是缩聚反应的产物 | B. | 高分子的分子式是C4H6O2 | ||
| C. | 合成它的单体是CH2=CHCOOCH3 | D. | 高分子的相对分子质量是86 |
16.下列各组顺序排列不正确的是( )
| A. | 离子半径:S2->O2->Na+>Al3+ | B. | 热稳定性:HCl>H2S>PH3>AsH3 | ||
| C. | 电负性:F>O>N>C | D. | 第一电离能:F>O>N>C |
3.将一定量A、B装入容积为1L的恒温密闭容器中,发生反应:2A(g)+bB(g)?cC(g),1min时达到平衡,C的浓度为x mol•L-1.若保持温度不变,将密闭容器的容积压缩为原来的$\frac{1}{2}$,重新达到平衡后,C的浓度为2.5x mol•L-1,下列说法正确的是( )
| A. | 化学计量数的关系:b<c | |
| B. | 容器的容积减小后,该反应的逆反应速率减小 | |
| C. | 原容器中用B浓度变化表示该反应在1 min内的速率为$\frac{cx}{b}$mol•(L•min)-1 | |
| D. | 若保持温度和容器容积不变,充入氦气(不参与反应),平衡不发生移动 |
20.某酯A的化学式为C6H12O2,已知A~E有如图转化关系,C、E均不能发生银镜反应,则A结构可能有( )

| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
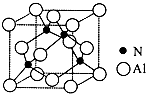 Ⅰ. 已知氮化铝的晶胞结构如图所示,请回答下列问题.
Ⅰ. 已知氮化铝的晶胞结构如图所示,请回答下列问题.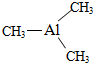 ,则其
,则其