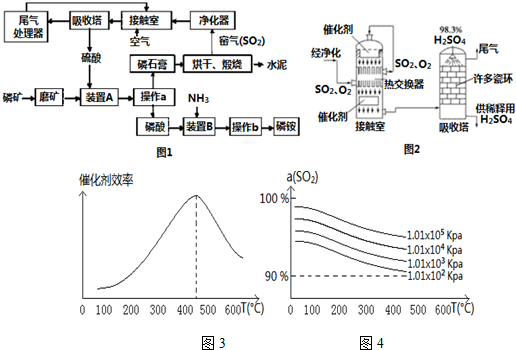
题目内容
16.增大压强,对已达平衡的反应3A(g)+B(g)═2C(g)+2D(s)产生的影响是( )| A. | 正、逆反应速率都加大,平衡向正反应方向移动 | |
| B. | 正、逆反应速率都没有变化,平衡不发生移动 | |
| C. | 正反应速率加大,逆反应速率减小,平衡向正反应方向移动 | |
| D. | 正反应速率减小,逆反应速率加大,平衡向逆反应方向移动 |
分析 对气体参加的反应,增大压强,正逆反应速率均增大,且该反应为气体体积减小的反应,以此来解答.
解答 解:3A(g)+B(g)═2C(g)+2D(s)为气体体积减小的反应,增大压强,正逆反应速率均增大,且正反应速率大于逆反应速率,平衡正向移动,
故选A.
点评 本题考查化学平衡的影响因素,为高频考点,把握反应的特点、压强对平衡移动的影响为解答的关键,侧重分析与应用能力的考查,注意平衡移动原理的应用,题目难度不大.

练习册系列答案
 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
12.下列对实验过程的评价正确的是( )
| A. | 某固体中加入稀盐酸,产生了无色气体,证明该固体一定是CaCO3 | |
| B. | 某溶液中滴加BaCl2溶液,生成不溶于稀硝酸的白色沉淀,该溶液中一定含SO42- | |
| C. | 验证烧碱溶液中是否含有Cl-,先加稀盐酸除去OH-,再加硝酸银溶液,有白色沉淀出现,证明含Cl- | |
| D. | 某无色溶液滴入无色酚酞试液显红色,该溶液一定显碱性 |
7.苯甲酸广泛应用于制药和化工行业.某同学尝试用甲苯的氧化反应制备苯甲酸.
反应原理:
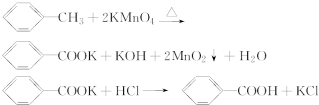
实验方法:一定量的甲苯和KMnO4溶液在100℃反应一段时间后停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯.
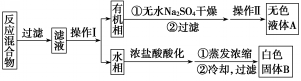
已知:苯甲酸分子量122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3g和6.9g;纯净固体有机物一般都有固定熔点.
(1)操作Ⅰ为分液,操作Ⅱ为蒸馏.
(2)无色液体A是甲苯,定性检验A的试剂是酸性KMnO4溶液,现象是紫色溶液褪色.
(3)测定白色固体B的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔.该同学推测白色固体B是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确.请在完成表中内容.
(4)纯度测定:称取1.220g产品,配成100mL苯甲酸溶液,移取25.00mL溶液,滴定,消耗KOH的物质的量为2.40×10-3 mol,产品中苯甲酸质量分数的计算结果为96%(保留2位有效数字).
反应原理:

实验方法:一定量的甲苯和KMnO4溶液在100℃反应一段时间后停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯.

已知:苯甲酸分子量122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3g和6.9g;纯净固体有机物一般都有固定熔点.
(1)操作Ⅰ为分液,操作Ⅱ为蒸馏.
(2)无色液体A是甲苯,定性检验A的试剂是酸性KMnO4溶液,现象是紫色溶液褪色.
(3)测定白色固体B的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔.该同学推测白色固体B是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确.请在完成表中内容.
| 序号 | 实验方案 | 实验现象 | 结果 |
| ① | 将白色固体B加入水中,加热溶解,冷却结晶,过滤 | 得到白色晶体和无色滤液 | |
| ② | 取少量滤液于试管中,滴入适量的硝酸酸化的AgNO3溶液 | 生成白色沉淀 | 滤液含Cl- |
| ③ | 干燥白色晶体,取适量加热,测定熔点 | 白色晶体在122.4℃熔化为液体 | 白色晶体是苯甲酸 |
11.下述反应在密闭容器中已建立平衡:SO2(气)+NO2(气)?NO(气)+SO3(气)若向容器中通入一定量的氧气,此时会发生的变化是( )
| A. | 平衡向正反应方向移动 | |
| B. | 平衡向逆反应方向移动 | |
| C. | 平衡不移动,但容器内的压强将增大 | |
| D. | 平衡不移动,且容器内的压强不变 |
8.在下列各组物质中,分子数相同的是( )
| A. | 2LCO和2LCO2 | B. | 9g H2O和标准状况下11.2LCO2 | ||
| C. | 标准状况下1molO2和22.4LH2O | D. | 0.2molH2和22.4LHCl气体 |
5.做焰色反应实验用的铂丝,每试验一种样品后都必须进行的操作是( )
| A. | 用水洗涤2~3次后再使用 | |
| B. | 用滤纸擦干后才可使用 | |
| C. | 用盐酸洗涤后,再在酒精灯火焰上灼烧到没有颜色,才可使用 | |
| D. | 用盐酸洗涤后,经蒸馏水冲洗,方可使用 |
6.下列物质属于纯净物的是( )
| A. | 冰水混合物 | B. | 玻璃 | C. | 空气 | D. | 漂白粉 |
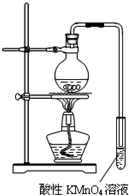 某学习小组探究溴乙烷的消去反应并验证产物.
某学习小组探究溴乙烷的消去反应并验证产物.