题目内容
X、Y、Z、W四种短周期元素,原子序数依次增大.X原子的最外层上p电子数与s电子数相等;Y有两种常见的同素异形体,其中一种是很好的脱色剂和消毒剂;Z、W原子最外层电子数之和是X最外层电子数的2倍;这四种元素的电子层数之和为10.据此推断下列说法不正确的是( )
分析:X、Y、Z、W四种元素的原子序数依次增大,且均为短周期元素.X原子最外层电子数是次外层电子数的2倍,则X为碳元素;Y有两种常见的同素异形体,其中一种是很好的脱色剂和消毒剂,则Y为氧元素;Z、W原子最外层电子数之和是X原子最外层电子数的2倍,这四种元素的原子电子层数之和为10,若Z为第三周期第ⅠA族元素,即Z为钠元素,W为第三周期第
ⅥⅠA族元素,即W为氯元素符合题意;若Z为第三周期第ⅡA族元素,即Z为镁元素,W为第三周期第ⅥA族元素,即W为硫元素也符合题意;若Z为第三周期第ⅢA族元素,即Z为铝元素,W为第三周期第ⅤA族元素,即W为磷元素也符合题意.
ⅥⅠA族元素,即W为氯元素符合题意;若Z为第三周期第ⅡA族元素,即Z为镁元素,W为第三周期第ⅥA族元素,即W为硫元素也符合题意;若Z为第三周期第ⅢA族元素,即Z为铝元素,W为第三周期第ⅤA族元素,即W为磷元素也符合题意.
解答:解:A.XY2是二氧化碳,二氧化碳晶体属于分子晶体,它可用作致冷剂,故A正确;
B.若W的单质是有毒气体,则W是氯气,Z是Na,则Na和O可形成含有非极性共价键的离子化合物Na2O2,故B正确;
C.若W的单质是淡黄色固体,W为S元素,则C和S可形成含极性键的非极性分子CS2,故C正确;
D.若W的一种单质为正四面体结构,所以W是P元素,则Z是Al元素,Z的最高价氧化物的水化物Al(OH)3是一种弱碱,故D错误;
故选D.
B.若W的单质是有毒气体,则W是氯气,Z是Na,则Na和O可形成含有非极性共价键的离子化合物Na2O2,故B正确;
C.若W的单质是淡黄色固体,W为S元素,则C和S可形成含极性键的非极性分子CS2,故C正确;
D.若W的一种单质为正四面体结构,所以W是P元素,则Z是Al元素,Z的最高价氧化物的水化物Al(OH)3是一种弱碱,故D错误;
故选D.
点评:本题较难,考查学生利用原子的结构来推断元素,注意本题中Z、W可能存在的三种情况来分析是解答本题的难点,然后结合元素化合物知识即可解答.

练习册系列答案
相关题目
已知X、Y、Z、W四种短周期主族元素在周期表中的相对位置如图所示,下列说法正确的是( )
| X | Y |
| Z | W |
| A、W的原子序数可能是Y的原子序数的2倍 |
| B、Z元素的原子半径可能比Y元素的小 |
| C、W的气态氢化物的稳定性一定比Y的强 |
| D、若Z的最高正价为+m,则X的最高正价也一定为+m |
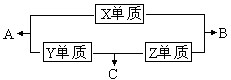 X、Y、Z、W四种短周期元素,其中X、Y、Z的原子序数之和为16,X、Y、Z三种元素的常见单质在常温常压下都是无色气体,在适当的条件下可以发生如下图所示的变化:
X、Y、Z、W四种短周期元素,其中X、Y、Z的原子序数之和为16,X、Y、Z三种元素的常见单质在常温常压下都是无色气体,在适当的条件下可以发生如下图所示的变化:
 有X、Y、Z、W四种短周期元素的位置关系如图所示,已知W为该族中半径最小的元素,Z为该周期中原子半径最小的元素.
有X、Y、Z、W四种短周期元素的位置关系如图所示,已知W为该族中半径最小的元素,Z为该周期中原子半径最小的元素.
