题目内容
常温下,将20.0g质量分数为14.0%的KNO3溶液跟30.0g质量分数为24.0%的KNO3溶液混合,得到密度为1.15g·cm-3的混合溶液。计算:
(1)混合后溶液的质量分数。
(2)混合后溶液的物质的量浓度。
(3)在1 000g水中需溶解多少摩尔KNO3才能使其浓度恰好与上述混合后溶液的浓度相等?
(1)20% (2)2.28mol·L-1(3)2.48mol
解析试题分析:(1)混合液中KNO3的质量是20.0g×14.0%+30.0×24.0%=10.0g,混合液的总质量是20.0g+30.0g=50.0g,所以混合后溶液的质量分数为10.0g/50.0g×100%=20%;
(2)混合液中KNO3的质量是20.0g×14.0%+30.0×24.0%=10.0g,物质的量是10.0g/10g/mol=0.099mol,混合液的总质量是20.0g+30.0g=50.0g,体积是50.0g/1.15g·cm-3=0.0434L,所以混合溶液的物质的量浓度是0.099mol/0.0434L=2.28mol·L-1;
(3)由(1)知混合溶液的质量分数是20%,则设需要xmolKNO3才能使其浓度恰好与上述混合后溶液的浓度相等,则101x/(1000+101x)×100%=20%,解得x=2.48mol。
考点:考查混合溶液浓度的计算

 名校课堂系列答案
名校课堂系列答案在花瓶中加入“鲜花保鲜剂”,能延长鲜花的寿命。
(1)现有一种无色的鲜花营养液,可能由硝酸钙、碳酸钾、硝酸钾、氯化钾中的一种或几种物质组成,为探究其成分,某同学设计并完成了如下图所示的实验。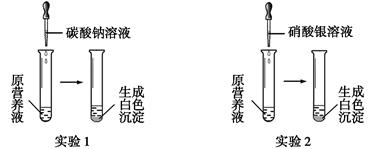
根据以上实验,请你填空。
①由实验1可确定原营养液中一定没有的物质是 (填化学式),写出生成白色沉淀的离子方程式是 。
②若测得原营养液中K+、Cl-的数目之比为2∶1,则原营养液是由 种溶质配制成的。
③某同学用氯化钙、硝酸钾、氯化钾配成的营养液中K+、Cl-、NO3-的数目之比为2∶5∶1,
则所用硝酸钾和氯化钙的物质的量之比是 。
(2)下表是500mL某“鲜花保鲜剂”中含有的成分,阅读后回答下列问题。
| 成分 | 质量(g) | 摩尔质量(g ·mol-1) |
| 蔗糖 | 68.4 | 342 |
| 硫酸钾 | 0.50 | 174 |
| 阿司匹林 | 0.35 | 180 |
| 高锰酸钾 | 0.50 | 158 |
| 硝酸银 | 0.04 | 170 |
①“鲜花保鲜剂”中蔗糖的物质的量浓度为___________________。
②配制该500mL “鲜花保鲜剂”所需的玻璃仪器除了烧杯、玻璃棒、量筒外还有 。
③在溶液配制过程中,下列操作能使配制结果偏小的是___________。
A.定容时仰视容量瓶刻度线
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.移液时,液体不小心从外壁流出
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理

 2MgO+C)。若将6 g镁粉在下列不同条件下点燃。
2MgO+C)。若将6 g镁粉在下列不同条件下点燃。