题目内容
 (2013?江苏三模)研究证明,Fe、Fe2+、Fe3+易与CO、CN-等形成配合物.
(2013?江苏三模)研究证明,Fe、Fe2+、Fe3+易与CO、CN-等形成配合物.(1)配合物Fe(CO)5会使合成氨等生产过程中的催化剂中毒.
①Fe(CO)5中铁的化合价为0,写出铁原子基态的电子排布式:
1s22s22p63s23p63d64s2或[Ar]3d64s2
1s22s22p63s23p63d64s2或[Ar]3d64s2
.该物质中含有的化学键类型有BD
BD
(填字母).A.离子键 B.极性共价键C.非极性共价键D.配位键
②常温下Fe(CO)5呈液态,熔点为-20.5℃,沸点为103℃.据此可以判断Fe(CO)5晶体的类型为
分子晶体
分子晶体
.(2)Fe、Fe2+都能被硝酸氧化.硝酸中氮原子轨道的杂化类型为
sp2
sp2
.(3)若向氯化铁溶液中加入少量的K4[Fe(CN)6]溶液,可生成蓝色沉淀KFe[Fe(CN)6],如图所示的是该晶体晶胞的八分之一(K+未画出).
①写出与CN-互为等电子体的一种分子的化学式:
N2
N2
.②该晶体的一个晶胞中含有的K+的个数为
4
4
.分析:(1)①根据构造原理写出基态铁原子核外电子排布式,含有空轨道和含有孤电子对的原子间易形成配位键,不同非金属元素之间易形成极性共价键;
②分子晶体的熔沸点较低;
(2)根据价层电子对互斥理论确定杂化方式;
(3)①原子个数相同且价电子数相同的微粒是等电子体;
②根据均摊法确定铁离子、亚铁离子和CN-的个数,再结合化合价的代数和为0确定钾离子个数.
②分子晶体的熔沸点较低;
(2)根据价层电子对互斥理论确定杂化方式;
(3)①原子个数相同且价电子数相同的微粒是等电子体;
②根据均摊法确定铁离子、亚铁离子和CN-的个数,再结合化合价的代数和为0确定钾离子个数.
解答:解:(1)①铁是26号元素,其原子核外有26个电子,根据构造原理知其基态原子核外电子排布式为:1s22s22p63s23p63d64s2或[Ar]3d64s2,铁原子和羰基之间存在配位键,碳原子和氧原子之间存在非极性共价键,故选BD,故答案为:1s22s22p63s23p63d64s2或[Ar]3d64s2;BD;
②分子晶体的熔沸点都较低,常温下Fe(CO)5呈液态,熔点为-20.5℃,沸点为103℃,据此可以判断Fe(CO)5晶体的类型为分子晶体,故答案为:分子晶体;
(2)硝酸分子中氮原子含有3个共价单键,且不含孤电子对,所以氮原子的价层电子对是3,则氮原子采用sp2杂化,故答案为:sp2;
(3)①CN-中含有两个原子且价电子数是10,所以与CN-互为等电子体的一种分子的化学式:N2,故答案为:N2;
②该晶体晶胞的
中亚铁离子个数=4×
=
,铁离子个数=4×
=
,CN-个数=12×
=3,所以该晶胞中含有4个亚铁离子,4个铁离子,24个CN-,据化合物中化合价的代数和为0知,钾离子个数=
=4,故答案为:4.
②分子晶体的熔沸点都较低,常温下Fe(CO)5呈液态,熔点为-20.5℃,沸点为103℃,据此可以判断Fe(CO)5晶体的类型为分子晶体,故答案为:分子晶体;
(2)硝酸分子中氮原子含有3个共价单键,且不含孤电子对,所以氮原子的价层电子对是3,则氮原子采用sp2杂化,故答案为:sp2;
(3)①CN-中含有两个原子且价电子数是10,所以与CN-互为等电子体的一种分子的化学式:N2,故答案为:N2;
②该晶体晶胞的
| 1 |
| 8 |
| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 4 |
| 24×1-2×4-3×4 |
| 1 |
点评:本题考查物质结构和性质,涉及知识点较多,难点是钾离子个数的确定,注意画出的图是晶胞的
而不是一个晶胞,为易错点.
| 1 |
| 8 |

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目
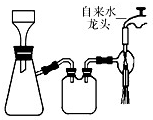 (2013?江苏三模)三草酸合铁(Ⅲ)酸钾晶体的化学式为K3[Fe(C2O4)3]?nH2O,常作为有机反应的催化剂.实验室可用(NH4)2Fe(SO4)2?2H2O等为原料制备,实验步骤如下:
(2013?江苏三模)三草酸合铁(Ⅲ)酸钾晶体的化学式为K3[Fe(C2O4)3]?nH2O,常作为有机反应的催化剂.实验室可用(NH4)2Fe(SO4)2?2H2O等为原料制备,实验步骤如下: