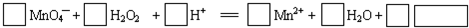题目内容
9.高温条件下反应达到平衡时的平衡常数K=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$.恒容条件下升高温度,H2浓度减小.则下列说法正确的是( )| A. | 反应的热化学方程式可表示为:CO(g)+H2O(g)$?_{高温高压}^{催化剂}$CO2(g)+H2(g)△H<0 kJ/mol | |
| B. | 恒温恒容下,增大压强,H2浓度一定减小 | |
| C. | 升高温度,逆反应速率减小 | |
| D. | 该反应的正反应为放热反应 |
分析 化学平衡常数,是指在一定温度下,可逆反应达到平衡时,各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,某反应达到平衡,平衡常数K=$\frac{c(CO)c({H}_{2}O)}{c(C{O}_{2})c({H}_{2})}$,可知该可逆反应为CO2(g)+H2(g)?CO(g)+H2O(g),恒容时,温度升高,H2的浓度减小,说明平衡向正反应移动,该反应正反应为吸热反应,据此分析.
解答 解:A、该可逆反应为CO2(g)+H2(g)?CO(g)+H2O(g),正反应为吸热反应,所以其逆反应放热,CO(g)+H2O(g)$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$O2(g)+H2(g)△H<0 kJ/mol,故A正确;
B、恒温恒容时,增大氢气的浓度,增大压强,平衡向正反应移动,平衡时氢气的浓度增大,故B错误;
C、升温,正逆反应速率都增大,故C错误;
D、该反应正反应为吸热反应,故D错误;
故选A.
点评 本题考查外界条件对化学平衡的影响、化学平衡常数等,难度中等,注意可逆反应的正逆反应的焓变互为相反数.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
17.有五瓶失去标签的溶液,它们分别为:①Ba(NO3)2;②KCl;③NaOH;④CuSO4;⑤Na2SO4.如果不用其他任何试剂(包括试纸),用最简便的方法将它们一一鉴别开,则在下列的鉴别顺序中,最合理的是( )
| A. | ④③①⑤② | B. | ①④③⑤② | C. | ①⑤③④② | D. | ③④①⑤② |
4.下列依据热化学方程式得出的结论正确的是( )
| A. | 已知2SO2(g)+O2(g)?2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量 | |
| B. | 已知C(s,石墨)═C(s,金刚石)△H>0,则金刚石比石墨稳定 | |
| C. | 已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,则任何酸碱中和反应的热效应均为57.3 kJ | |
| D. | 已知2C(s)+2O2(g)═2CO2(g)△H1,2C(s)+O2(g)═2CO(g)△H2,则△H1<△H2 |
14.下列叙述错误的是( )
| A. | 在热化学方程式中,物质化学式前面的化学计量数可以为整数也可以为简单分数 | |
| B. | 同一化学反应,热化学方程式中物质的化学计量数不同,反应的△H也不同 | |
| C. |  N2(g)与O2(g)反应生成NO(g)过程中的能量变化如图所示,若加入催化剂,化学反应速率改变,△H也改变 N2(g)与O2(g)反应生成NO(g)过程中的能量变化如图所示,若加入催化剂,化学反应速率改变,△H也改变 | |
| D. | 化学反应中化学键的断裂和形成是反应过程中有能量变化的本质原因 |
1.下列说法中不正确的是( )
| A. | 酸雨会腐蚀大理石雕像 | |
| B. | 超量使用着色剂对人体是无害的 | |
| C. | 大气污染物既危害人体健康,又影响动植物的生长 | |
| D. | 食物中的维生素和微量元素可以提供人体的正常需要 |
18.下列说法正确的是( )
| A. | 增大压强,活化分子百分数增大,化学反应速率一定增大 | |
| B. | 升高温度,活化分子百分数增大,化学反应速率可能增大 | |
| C. | 加入反应物,使活化分子百分数增大,化学反应速率增大 | |
| D. | 使用正催化剂可以降低反应的活化能,增大活化分子百分数,增大化学反应速率 |