题目内容
【题目】已知:![]()
![]() 。在
。在![]() 的密闭容器中进行模拟合成实验,将
的密闭容器中进行模拟合成实验,将![]() 和
和![]() 通入容器中,分别在
通入容器中,分别在![]() 和
和![]() 反应,每隔一段时间测得容器中的甲醇的浓度如下:
反应,每隔一段时间测得容器中的甲醇的浓度如下:
| 10 | 20 | 30 | 40 | 50 | 60 |
300 | 0.40 | 0.60 | 0.75 | 0.84 | 0.90 | 0.90 |
500 | 0.60 | 0.75 | 0.78 | 0.80 | 0.80 | 0.80 |
下列说法正确的是 ![]()
![]()
A.![]() 时,开始
时,开始![]() 内
内![]() 的平均反应速率
的平均反应速率![]()
B.反应达到平衡时,两温度下CO和![]() 的转化率之比均为
的转化率之比均为![]()
C.![]() 反应达到平衡时,放出的热量为
反应达到平衡时,放出的热量为![]()
D.![]() 时,若容器的容积压缩到原来的
时,若容器的容积压缩到原来的![]() ,则
,则![]() 增大,
增大,![]() 减小
减小
【答案】B
【解析】
A. ![]() 时,开始10min内甲醇的平均速率
时,开始10min内甲醇的平均速率![]() -1·min-1,依据速率与方程式的计量数的关系可得,H2的平均速率v(H2)=0.08mol·L-1·min-1,故A错误;
-1·min-1,依据速率与方程式的计量数的关系可得,H2的平均速率v(H2)=0.08mol·L-1·min-1,故A错误;
B. 两温度下,起始时CO和H2的物质的量之比是方程式的系数比,反应时也是按照方程式的系数比转化的,所以反应达到平衡时,CO和H2的转化率之比为1:1,故B正确;
C. ![]() 反应达到平衡时,放出的热量为
反应达到平衡时,放出的热量为![]() kJ,故C错误;
kJ,故C错误;
D. ![]() 时,若容器的容积压缩到原来的
时,若容器的容积压缩到原来的![]() ,依据压强与反应速率的关系,则v
,依据压强与反应速率的关系,则v![]() 增大,v
增大,v![]() 增大,故D错误。
增大,故D错误。
故选B。

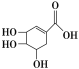
【题目】硼及其化合物在化学工业中有诸多用途。请回答下列问题:
(1)硼氢化钠NaBH4是硼的重要化合物。
①NaBH4中B元素的化合价为______。
![]() 工业上可利用硼酸甲酯B(OCH3)3与氢化钠NaH反应制备NaBH4,反应的另一种产物为甲醇钠(CH3ONa),该反应的化学方程式为______。
工业上可利用硼酸甲酯B(OCH3)3与氢化钠NaH反应制备NaBH4,反应的另一种产物为甲醇钠(CH3ONa),该反应的化学方程式为______。
③NaBH4与水反应生成NaBO2和H2,该反应生成的氧化产物与还原产物的物质的量之比为______。
(2)工业上以铁硼矿![]() 主要成分为Mg2B2O5·H2O和Fe3O4,还有少量
主要成分为Mg2B2O5·H2O和Fe3O4,还有少量![]() 、FeO、CaO、
、FeO、CaO、![]() 和
和![]() 等
等![]() 为原料制备单质B的工艺流程如图所示:
为原料制备单质B的工艺流程如图所示:

已知:
金属离子 | Fe3+ | Al3+ |
开始沉淀的pH | 2.7 | 3.1 |
沉淀完全的pH | 3.7 | 4.9 |
![]() “浸出”时,将铁硼矿石粉碎的目的为______。
“浸出”时,将铁硼矿石粉碎的目的为______。
![]() 滤渣1的主要成分为______。
滤渣1的主要成分为______。
![]() “净化除杂”时需先加H2O2溶液,其目的为______,然后再调节溶液的pH≈5.0的目的是______。
“净化除杂”时需先加H2O2溶液,其目的为______,然后再调节溶液的pH≈5.0的目的是______。
![]() 制得的粗硼在一定条件下能生成BI3,BI3加热分解可以得到纯净的单质硼。现将
制得的粗硼在一定条件下能生成BI3,BI3加热分解可以得到纯净的单质硼。现将![]() 粗硼制成的BI3完全分解,生成的
粗硼制成的BI3完全分解,生成的![]() 用0.30mol·L-1Na2S2O3溶液滴定
用0.30mol·L-1Na2S2O3溶液滴定![]() 至终点,消耗18.00mL Na2S2O3溶液。盛装Na2S2O3溶液应用______
至终点,消耗18.00mL Na2S2O3溶液。盛装Na2S2O3溶液应用______![]() 填“酸式”或“碱式”
填“酸式”或“碱式”![]() 滴定管,该粗硼样品的纯度为______。
滴定管,该粗硼样品的纯度为______。
【题目】![]() 分解速率受多种因素影响。实验测得
分解速率受多种因素影响。实验测得![]() 时不同条件下
时不同条件下![]() 浓度随时间的变化如图所示
浓度随时间的变化如图所示![]() 起始浓度均为
起始浓度均为![]() 。下列说法正确的是
。下列说法正确的是![]()
![]()
实验条件 |
|
|
|
① | 0 | 0 | |
② |
| 0 | |
③ |
| 3 | |
④ |
| 3 |
A.![]() 内,④条件下
内,④条件下![]() 的平均反应速率为
的平均反应速率为![]()
B.分析②③条件可知,![]() 浓度越大,
浓度越大,![]() 分解速率越慢
分解速率越慢
C.少量![]() 存在时,溶液碱性越强,
存在时,溶液碱性越强,![]() 分解速率越快
分解速率越快
D.分析①②条件可知,无![]() 时,碱性条件有利于双氧水的分解
时,碱性条件有利于双氧水的分解