题目内容
下图为Fe(OH)2制备实验的改进装置,使用该装置将能在较长时间内观察到白色絮状沉淀.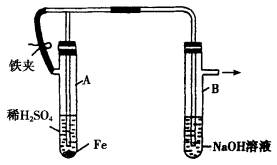
(1)如何操作该装置才能得到Fe(OH)2沉淀?
(2)为何能在较长时间内观察到Fe(OH)2白色沉淀?
答案:
解析:
解析:
| 答案:(1)装入药品后,先打开铁夹,H2通过导气管进入试管B,把NaOH溶液中溶解的空气及溶液上方的空气都由试管B的支管排出,待反应较缓时,夹住铁夹,产生的H2的压力将含Fe2+的溶液由A压入B中的NaOH溶液中,产生白色的Fe(OH)2沉淀.
(2)因为Fe(OH)2是在H2的还原性气氛中产生的. 对铁,卤素性质没有全面掌握,出现知识真空.
|

练习册系列答案
相关题目
(12分)化学实验室通常用粗锌和稀硫酸反应制氢气,因此在制氢废液中含有大量的硫酸锌。同时,由于粗锌中还含有铁等杂质,使得溶液中混有一定量的硫酸亚铁,为了充分利用制氢废液,常用其制备皓矾(ZnSO4·7H2O)。某校化学兴趣小组的同学以制氢气的废液为原料来制取皓矾并探究其性质。
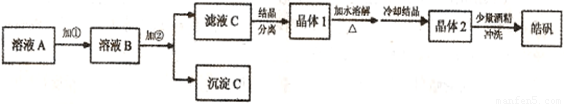 (l)制备皓矾的实验流程如下图所示。
(l)制备皓矾的实验流程如下图所示。
已知:下列氢氧化物开始生成沉淀到沉淀完全的pH范围分别为:
|
|
开始沉淀 |
沉淀完全 |
|
Fe(OH)3 |
2.7 |
3.7 |
|
Fe(OH)2 |
7.6 |
9.6 |
|
Zn(OH)2 |
5.7 |
8.0 |
回答下列问题:
可供选择使用的有:氯水、20%的H2O2、氨水、NaOH溶液、Zn(OH)2、ZnO
① 加入的试剂①,应选用 ,作用: 。
② 加入的试剂②调节pH,可选用 或 ,用离子方程式表示其原理
。
③有同学提出,应将晶体1加入稀硫酸中溶解,原因是 。
④在得到皓矾时,向晶体中加入少量酒精洗涤而不用水的原因是 。
(2)检验皓矾中是否含有Fe元素的操作(试剂自选) 。


