题目内容
下列说法不正确的是
| A.加热或稀释NH4Cl溶液,NH4Cl水解程度均增大 |
| B.滴有酚酞试液的氨水中加入NH4Cl固体,溶液颜色变浅 |
| C.含有NH4Cl的氨水中,[NH4+]可能大于[Cl-] |
| D.纯水中加入少量NH4Cl固体,恢复到原温度,水的电离平衡右移且电离常数变大 |
D
解析试题分析:A、盐类的水解为吸热反应,加热NH4Cl水解程度增大,稀释NH4Cl溶液,水解程度增大,正确;B、滴有酚酞试液的氨水中加入NH4Cl固体,增加了NH4+浓度,使氨水的电离程度减小,溶液颜色变浅,正确;C、若氨水过量较多,氨水电离出NH4+,[NH4+]大于[Cl-],正确;D、加入NH4Cl,NH4+发生水解反应,恢复到原温度,水的电离平衡右移但电离常数不变,错误。
考点:本题考查盐类的水解、弱电解质的电离。

练习册系列答案
相关题目
一定温度下,在氢氧化钙的悬浊液中,存在氢氧化钙固体与其电离出的离子间溶解结晶平衡:Ca(OH)2(s)  Ca2+(aq)+2OHˉ(aq)。向此种悬浊液中加入少量的氧化钙粉末,充分反应后恢复到原温度。下列叙述正确的是
Ca2+(aq)+2OHˉ(aq)。向此种悬浊液中加入少量的氧化钙粉末,充分反应后恢复到原温度。下列叙述正确的是
| A.溶液中钙离子数目减小 | B.溶液中钙离子浓度减少 |
| C.溶液中氢氧根离子浓度增大 | D.pH减小 |
如图表示水溶液中c(H+)和c(OH-)的关系,下列说法正确的是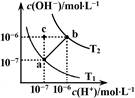
| A.ab线上任意点溶液均显中性 |
| B.b点时,溶液的pH=6,显酸性 |
| C.图中温度T1>T2 |
| D.在水中通入适量HCl气体可从a点变到c点 |
下列溶液中微粒浓度关系一定正确的是( )
| A.氨水与氯化铵的pH=7的混合溶液中:c(Cl-)>c(NH4+) |
| B.新制氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-) |
| C.室温下,向0.01 mol·L-1 NH4HSO4溶液中滴加等浓度等体积的NaOH溶液:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-) |
| D.pH=2的一元酸和pH=12的一元强碱等体积混合:c(OH-)=c(H+) |
酸式盐NaHY的水溶液中,HY-的电离程度小于HY-的水解程度。下列有关叙述正确的是 ( )
A.HY-水解方程式为:HY-+ H2O H3O++ Y2- H3O++ Y2- |
| B.在该盐的溶液中离子浓度大小关系为:c(Na+) >c(Y2-) >c(HY-) >c(OH-) >c(H+) |
C.H2Y的电离方程式为:H2Y+H2O HY-+H3O+ HY-+H3O+ |
| D.在该盐的溶液中:c(Na+) >c(HY-) >c(Y2-)>c(OH-)>c(H+) |
常温下0.1 mol·L-1醋酸溶液的pH=a,下列能使溶液pH=(a+1)的措施是( )
| A.将溶液稀释到原体积的 10倍 |
| B.加入适量的醋酸钠固体 |
| C.加入等体积0.2 mol·L-1盐酸 |
| D.提高溶液的温度 |
对于常温下pH均为4的三种溶液:①盐酸,②CH3COOH溶液,③NH4Cl溶液,下列说法中正确的是( )
| A.溶液中由水电离出的c(H+):②>③ |
| B.稀释100倍后溶液的pH:①<③ |
| C.中和相同体积的上述溶液消耗NaOH溶液的体积:①<② |
| D.②和③等体积混合后的溶液:c(CH3COO-)+c(Cl-)=c(NH) |
有关水的电离平衡的说法正确的是( )
| A.水的离子积通常用KW来表示,随温度变化而变化,只适用于纯水,在稀盐酸中数值会变大 |
| B.在纯水中加入硫酸会抑制水的电离,加醋酸会促进水的电离 |
| C.盐溶于水对水的电离平衡均没有影响 |
| D.在纯水中加入氢氧化铁固体对水的电离平衡会有微弱的影响 |