题目内容
19.将K2SO4、Al2(SO4)3两种盐混合于硫酸酸化的水中,测得c(SO42-)=0.03mol/L,c(Al3+)=0.005mol/L,c(H+)=0.01mol/L(假设溶液中H2SO4完全电离为H+和SO42-),则c(K+)为( )| A. | 0.045 mol/L | B. | 0.035 mol/L | C. | 0.005 mol/L | D. | 0.040 mol/L |
分析 混合液呈电中性,则溶液中3c(Al3+)+c(H+)+c(K+)=2c(SO42-)+c(OH-),溶液中c(OH-)可以忽略不计,结合题中数据进行计算钾离子浓度.
解答 解:溶液呈电中性,则溶液中满足:3c(Al3+)+c(H+)+c(K+)=2c(SO42-)+c(OH-),
溶液中c(OH-)可以忽略不计,
则:c(K+)=2c(SO42-)-c(H+)-3c(Al3+)=2×0.03mol/L-3×0.005mol/L-0.01mol/L=0.035mol/L,
故选B.
点评 本题考查物质的量浓度计算,题目难度中等,明确电荷守恒为解答关键,注意掌握物质的量浓度的概念及计算方法,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
17.醋酸的电离方程式为CH3COOH(aq)?H+(aq)+CH3COO-(aq)△H>0.25℃时,0.1mol/L醋酸溶液中存在下述关系:$\frac{c({H}^{+})•c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$=1.75×10-5,其中的数值是该温度下醋酸的电离平衡常数(Ka).下列说法正确的是( )
| A. | 向该溶液中滴加几滴浓盐酸,平衡逆向移动,c(H+)减小 | |
| B. | 向该溶液中加入少量CH3COONa固体,平衡正向移动 | |
| C. | 该温度下0.01mol/L醋酸溶液Ka<1.75×10-5 | |
| D. | 升高温度,c(H+)增大,Ka变大 |
7.把500mL含有BaCl2和KCl的混合溶液分成5等份,取一份加入含a mol硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含b mol硝酸银的溶液,恰好使氯离子完全沉淀.则该混合溶液中钾离子浓度为( )
| A. | 0.1(b-2a)mol•L-1 | B. | 10(2a-b)mol•L-1 | C. | 10(b-a)mol•L-1 | D. | 10(b-2a)mol•L-1 |
14.向含有等物质的量的NH4+、Al3+、H+混合溶液中,慢慢滴加NaOH溶液,直至过量,发生以下离子反应:①H++OH-═H2O ②Al(OH)3+OH-═AlO2-+2H2O ③Al3++3OH-═Al(OH)3↓④NH4++OH-═NH3•H2O.发生反应的先后顺序正确的是( )
| A. | ①→④→③→② | B. | ①→③→②→④ | C. | ①→③→④→② | D. | ①→②→③→④ |
4.下列有关金属的腐蚀的说法中,不正确的是( )
| A. | 纯银饰品久置表面变暗属于化学腐蚀 | |
| B. | 温度越高,金属发生化学腐蚀的速率越快 | |
| C. | 金属腐蚀就是金属失去电子被氧化的过程 | |
| D. | 铁门上的铜铆钉处在潮湿的空气中直接发生反应:Fe-3e-═Fe3+ |
9.鉴别乙酸、乙醛不能选用的试剂是( )
| A. | 银氨溶液 | B. | 碳酸氢钠 | C. | 新制氢氧化铜 | D. | 酚酞试液 |
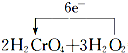 =2Cr(OH)3↓+3O2↑+2H2O.
=2Cr(OH)3↓+3O2↑+2H2O.