题目内容
2.在下列反应中能置换出铜的是( )①Na+CuSO4(溶液)②CuO+CO(加热)③CuO+H2(加热)④Fe+CuSO4(溶液)
| A. | ①②③④ | B. | ②③ | C. | ③④ | D. | ①④ |
分析 根据题意可知,须是通过置换反应生成金属铜,而置换反应是一种单质和一种化合物反应生成另一种单质和另一种化合物的反应,据此分析.
解答 解:①Na投入到CuSO4溶液中,钠先和水反应:2Na+2H2O=2NaOH+H2↑,然后NaOH和CuSO4反应:2NaOH+CuSO4=Cu(OH)2↓+Na2SO4,故生不成单质铜,故错误;
②CuO和CO在加热条件下能生成铜:CuO+CO$\frac{\underline{\;加热\;}}{\;}$Cu+CO2↑,但此反应不是置换反应,故错误;
③CuO和H2在加热条件下反应:CuO+H2$\frac{\underline{\;加热\;}}{\;}$Cu+H2O,能置换生成铜,故正确;④Fe和CuSO4溶液发生置换反应:Fe+CuSO4=FeSO4+Cu,故正确.
故选C.
点评 本题考查了置换反应的概念和常见反应的发生,应注意的是钠投入到盐溶液中,钠会先和水反应,生成的氢氧化钠再与盐反应.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.对反应14CuSO4+5FeS2+12H2O═7Cu2S+5FeSO4+12H2SO4的下列说法正确的是( )
| A. | 该反应的氧化剂只有CuSO4 | |
| B. | SO42-既不是氧化产物也不是还原产物 | |
| C. | 1molCuSO4氧化了$\frac{1}{7}$mol的S | |
| D. | 被还原的S和被氧化的S的质量比为3:7 |
13.下列叙述正确的是( )
| A. | 离子化合物中的阴离子肯定不存在金属元素 | |
| B. | 任何的阳离子只有氧化性,任何的阴离子只有还原性 | |
| C. | 与强酸、强碱都会反应的物质中只有两性氧化物或两性氢氧化物 | |
| D. | 根据化合物在水溶液中电离出的离子的类别,将化合物分为酸、碱、盐等 |
10.CoCl2•6H2O是一种饲料营养强化剂.一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2•6H2O的工艺流程如下:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
③CoCl2•6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴.
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“加Na2CO3调pH至a”,过滤所得到的沉淀成分为Fe(OH)3、Al(OH)3.
(4)“操作1”中包含3个基本实验操作,它们依次是蒸发浓缩、冷却结晶和过滤.制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
(5)萃取剂对金属离子的萃取率与pH的关系如图.向“滤液”中加入萃取剂的目的是除去溶液中的Mn2+;其使用的最佳pH范围是B.
A.2.0~2.5 B.3.0~3.5
C.4.0~4.5 D.5.0~5.5.

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“加Na2CO3调pH至a”,过滤所得到的沉淀成分为Fe(OH)3、Al(OH)3.
(4)“操作1”中包含3个基本实验操作,它们依次是蒸发浓缩、冷却结晶和过滤.制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
(5)萃取剂对金属离子的萃取率与pH的关系如图.向“滤液”中加入萃取剂的目的是除去溶液中的Mn2+;其使用的最佳pH范围是B.
A.2.0~2.5 B.3.0~3.5
C.4.0~4.5 D.5.0~5.5.
17.在一定温度下的恒容密闭容器中,当下列哪些量不再发生变化时,表明下述反应:A(s)+2B(g)=C(g)+D(g)已达到平衡状态:
①混合气体的压强 ②混合气体的密度 ③B的物质的量浓度 ④气体的总物质的量 ⑤混合气体的平均相对分子质量 ⑥物质C的百分含量 ⑦各气体的物质的量 ⑧当有1molB气体分子断键,同时有1/2molC气体分子断键( )
①混合气体的压强 ②混合气体的密度 ③B的物质的量浓度 ④气体的总物质的量 ⑤混合气体的平均相对分子质量 ⑥物质C的百分含量 ⑦各气体的物质的量 ⑧当有1molB气体分子断键,同时有1/2molC气体分子断键( )
| A. | ②③⑤⑥⑦⑧ | B. | ①②③⑥⑦⑧ | C. | ②③④⑤⑥⑧ | D. | ①③④⑤⑦ |
14.已知常温下NaHSO3 溶液的pH小于7,下列关于0.10mol•L-1 的NaHSO3 溶液的说法正确的是( )
| A. | c(Na+ )=c(HSO3-) | B. | c(H2SO3)>c(SO32-) | ||
| C. | c(Na+ )=c(SO32-)+c(HSO3-) | D. | c(Na+ )+c(H+)=c(OH-)+c(HSO3-)+2c(SO32-) |
4.加碘食盐中加入的碘酸钾是一种白色结晶粉末,常温下性质稳定,加热至560℃开始分解.在酸性条件下碘酸钾是一种较强的氧化剂,可与碘化物、亚硫酸盐等还原性物质反应.工业生产碘酸钾的流程如下:
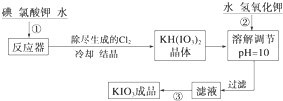
(1)已知步骤①反应器发生的反应中,单质碘和氯酸钾的物质的量之比为6:11,则反应器中发生反应的化学方程式为6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑.
(2)步骤②中调节pH=10的目的是使KH(IO3)2转化为KIO3.
参照碘酸钾的溶解度:
操作③的方法是蒸发结晶.
(3)检验加碘食盐中的碘元素,学生甲利用碘酸钾与碘化钾在酸性条件下发生反应,然后用四氯化碳检验生成的碘单质时,甲应观察到的明显现象有液体分层,下层液体呈现紫红色.
学生乙对纯净的NaCl进行了如下实验:取1g纯净的NaCl,加3mL水配成溶液,然后滴入5滴淀粉溶液和1mL 0.1mol•L-1 KI溶液,振荡,溶液无变化,然后再滴入1滴1mol•L-1的H2SO4,振荡,一段时间后溶液变浅蓝色.请推测实验中产生蓝色现象的可能原因,用离子方程式表示4I-+4H++O2═2I2+2H2O.
(4)学生丙查阅有关食品碘强化剂的资料后知道,碘酸钙也是一种允许使用的食品碘强化剂,它是一种白色结晶或结晶性粉末,难溶于水和乙醇.丙同学在氯化钙溶液中加入理论量的碘酸钾溶液,反应生成的沉淀经水洗后,室温下干燥得碘酸钙晶体,加热至160~540℃变成无水物,此时固体质量为原晶体质量的78.3%,写出制备碘酸钙晶体的离子方程式:Ca2++2IO${\;}_{3}^{-}$+6H2O═Ca(IO3)2•6H2O;检验沉淀已经洗涤干净的方法是在最后一次洗涤液中加入硝酸银溶液,若无白色沉淀说明已经洗涤干净.

(1)已知步骤①反应器发生的反应中,单质碘和氯酸钾的物质的量之比为6:11,则反应器中发生反应的化学方程式为6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑.
(2)步骤②中调节pH=10的目的是使KH(IO3)2转化为KIO3.
参照碘酸钾的溶解度:
| 温度/℃ | 20 | 40 | 60 | 80 |
| KIO3 g/100g H2O | 8.08 | 12.6 | 18.3 | 24.8 |
(3)检验加碘食盐中的碘元素,学生甲利用碘酸钾与碘化钾在酸性条件下发生反应,然后用四氯化碳检验生成的碘单质时,甲应观察到的明显现象有液体分层,下层液体呈现紫红色.
学生乙对纯净的NaCl进行了如下实验:取1g纯净的NaCl,加3mL水配成溶液,然后滴入5滴淀粉溶液和1mL 0.1mol•L-1 KI溶液,振荡,溶液无变化,然后再滴入1滴1mol•L-1的H2SO4,振荡,一段时间后溶液变浅蓝色.请推测实验中产生蓝色现象的可能原因,用离子方程式表示4I-+4H++O2═2I2+2H2O.
(4)学生丙查阅有关食品碘强化剂的资料后知道,碘酸钙也是一种允许使用的食品碘强化剂,它是一种白色结晶或结晶性粉末,难溶于水和乙醇.丙同学在氯化钙溶液中加入理论量的碘酸钾溶液,反应生成的沉淀经水洗后,室温下干燥得碘酸钙晶体,加热至160~540℃变成无水物,此时固体质量为原晶体质量的78.3%,写出制备碘酸钙晶体的离子方程式:Ca2++2IO${\;}_{3}^{-}$+6H2O═Ca(IO3)2•6H2O;检验沉淀已经洗涤干净的方法是在最后一次洗涤液中加入硝酸银溶液,若无白色沉淀说明已经洗涤干净.
5.铬(Cr)是重要的金属元素.
不同铬的化合物或离子的水溶液的颜色如下:
含铬元素的化合物可以发生如下一系列变化:

(1)反应①的还原剂是Zn,反应②的离子方程式为Cr3++3OH-═Cr(OH)3↓.
(2)在K2Cr2O7橙色溶液中逐滴加入NaOH溶液,溶液逐渐变为黄色,该反应的离子方程式为Cr2O72-+2OH-═2CrO42-+H2O.
(3)将KCl和CrCl3两种固体混合物共熔制得化合物X,将0.0035mol X中的Cr元素全部氧化成Cr2O72-,得到的Cr2O72-与过量的KI反应生成0.0105mol I2,反应的离子方程式为Cr2O72-+6I-+14H+═2Cr3++3I2+7H2O;
另取0.0035mol X溶于水中,当加入0.0315mol AgNO3时,恰好沉淀完全.则表示X组成的化学式为K3Cr2Cl9.
不同铬的化合物或离子的水溶液的颜色如下:
| 离子或化合物 | Cr2O72- | Cr(OH)3 | Cr(OH)4- | Cr3+ | CrO42- |
| 颜色 | 橙色 | 灰蓝色 | 绿色 | 绿色 | 黄色 |

(1)反应①的还原剂是Zn,反应②的离子方程式为Cr3++3OH-═Cr(OH)3↓.
(2)在K2Cr2O7橙色溶液中逐滴加入NaOH溶液,溶液逐渐变为黄色,该反应的离子方程式为Cr2O72-+2OH-═2CrO42-+H2O.
(3)将KCl和CrCl3两种固体混合物共熔制得化合物X,将0.0035mol X中的Cr元素全部氧化成Cr2O72-,得到的Cr2O72-与过量的KI反应生成0.0105mol I2,反应的离子方程式为Cr2O72-+6I-+14H+═2Cr3++3I2+7H2O;
另取0.0035mol X溶于水中,当加入0.0315mol AgNO3时,恰好沉淀完全.则表示X组成的化学式为K3Cr2Cl9.
 和
和 的合理试剂是氯化铁溶液.
的合理试剂是氯化铁溶液.