题目内容
13.下列有关物质性质的描述和该性质的应用均正确的是( )| A. | 铜的金属活动性比铝弱,可用铜罐代替铝罐贮运浓硝酸 | |
| B. | 氢氟酸具有强酸性,用氢氟酸蚀刻玻璃 | |
| C. | 过氧化钠只有氧化性,用过氧化钠为潜水艇舱提供氧气 | |
| D. | FeCl3具有氧化性,用FeCl3溶液刻蚀印刷电路板 |
分析 A.铜和浓硝酸在常温下反应;铝与浓硝酸发生钝化反应;
B.氢氟酸为弱酸;
C.过氧化钠具有氧化性和还原性;
D.氯化铁可与铜发生氧化还原反应.
解答 解:A.铜和浓硝酸在常温下反应,而铝与浓硝酸发生钝化反应,则可用铝罐贮运浓硝酸而不能用铜,故A错误;
B.氢氟酸为弱酸,但可与二氧化硅反应生成四氟化硅和水,与酸性强弱无关,故B错误;
C.过氧化钠中O元素化合价为-1价,处于中间价态,具有氧化性和还原性,可与水、二氧化碳反应生成氧气,反应中过氧化钠既为氧化剂也为还原剂,故C错误;
D.氯化铁可与铜发生氧化还原反应,可用于刻蚀印刷电路板,故D正确.
故选D.
点评 本题综合考查元素化合物知识,为高考常见题型,侧重于学生的分析能力和元素化合物知识的综合理解和运用的考查,注意把握相关基础知识的积累,难度不大.

练习册系列答案
相关题目
1.某二元酸(化学式H2A)在水中的电离方程式是H2A→H++HA-、HA?H++A2-又知0.1mol/L NaHA溶液的pH=2.则下列说法不正确的是( )
| A. | 因为A2-+H2O?HA-+OH-,所以Na2A溶液显碱性 | |
| B. | 0.1 mol/L H2A溶液中氢离子的物质的量浓度为0.11 mol/L | |
| C. | NaHA溶液中各种离子浓度的关系是c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) | |
| D. | 在NaHA溶液中,HA-电离的趋势大于其水解的趋势 |
8.下列组合判断正确的是( )
①Cl2具有很强的氧化性,在化学反应中只能作氧化剂
②浓H2SO4有强氧化性,常温下能与Cu发生剧烈反应
③化合反应均为氧化还原反应
④Cl2、SO2均能使品红溶液褪色,说明二者均有氧化性
⑤2Na2O2+2H2O=4NaOH+O2↑;Cl2+H2O=HCl+HClO 这两个反应中水均作还原剂.
①Cl2具有很强的氧化性,在化学反应中只能作氧化剂
②浓H2SO4有强氧化性,常温下能与Cu发生剧烈反应
③化合反应均为氧化还原反应
④Cl2、SO2均能使品红溶液褪色,说明二者均有氧化性
⑤2Na2O2+2H2O=4NaOH+O2↑;Cl2+H2O=HCl+HClO 这两个反应中水均作还原剂.
| A. | ①②不正确,③④⑤正确 | B. | ①②③④⑤均不正确 | ||
| C. | ①②正确,③④⑤不正确 | D. | ①②③④正确 |
18.室温下,用含 0.2mol NaOH的溶液恰好吸收0.2mol NO2后所得溶液为1L,反应的化学方程式为2NO2+2NaOH→NaNO3+NaNO2+H2O.对反应后的溶液,下列说法正确的是[已知:Ka(HNO2)=7.1×10-4、Ka(CH3COOH)=1.7×10-5]( )
| A. | n(NO2-)+n(OH-)-n(H+)=0.1 mol | |
| B. | 若加入少量CH3COONa固体,溶液的碱性会减弱 | |
| C. | 若再通入0.01 mol HCl气体,溶液pH大于2(忽略溶液体积的变化) | |
| D. | 此时溶液的pH大于0.1 mol•L-1的CH3COONa溶液 |
5.下列各项所述内容对应的图象不正确的是( )
| A. |  向Ba(OH)2溶液中加稀H2SO4 | B. | 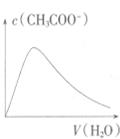 向冰醋酸中加蒸馏水 | ||
| C. |  向稀NaOH溶液中加稀盐酸 | D. | 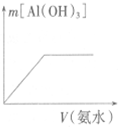 向AlCl3溶液中加氨水 |
2.已知H2O2是一种弱酸,在强碱溶液中主要以HO2-形式存在.以Al-H2O2燃料电池电解尿素的碱性溶液制备氢气 (电解池中隔膜仅阻止气体通过,c、d均为惰性电极).下列说法不正确的是( )


| A. | 电解过程中,电子的流向由a→b→c→d | |
| B. | 电极b是正极,且反应后该电极区pH增大 | |
| C. | 燃料电池的总反应为:2Al+3HO2-=2AlO2-+OH-+H2O | |
| D. | 电解时,Al消耗2.7g,则产生氮气标准状况下为1.12L |
20.下列关于元素周期表的结构的叙述中正确的是( )
| A. | 除短周期外,其他周期均有18种元素 | |
| B. | 副族元素中没有非金属元素 | |
| C. | 周期表中的第三列是ⅢA | |
| D. | 在过渡元素区能找到大量单质半导体材料 |
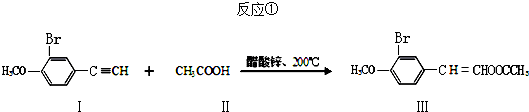
 (任写其中一种)
(任写其中一种) 涂料的单体,化合物Ⅴ单体结构简式为CH3COOCH=CHCH3.
涂料的单体,化合物Ⅴ单体结构简式为CH3COOCH=CHCH3. .利用类似反应①的方法,仅以丙炔和乙酸为有机物原料合成该单体,写出反应方程式
.利用类似反应①的方法,仅以丙炔和乙酸为有机物原料合成该单体,写出反应方程式 .
.