题目内容
对实验Ⅰ~Ⅳ的实验现象预测正确的是

(提示:Ca(OH)2+2NH4Cl=2NH3↑+CaCl2+2H2O)
- A.实验Ⅰ:液体分层,下层呈无色
- B.实验Ⅱ:烧杯中先出现白色沉淀后溶解
- C.实验Ⅲ:试管中溶液出现红色沉淀物
- D.实验Ⅳ:放置一段时间后,饱和CuSO4溶液中出现蓝色晶体
D
试题分析:I中CCl4密度比水大,下层呈紫红色,A错误;氨气通入氯化铝溶液生成白色沉淀,氨气过量,沉淀不溶解,B错误;氯化铁溶液与硫氰化钾溶液生成血红色溶液,C错误。
考点:化学实验
点评:氢氧化铝是两性氢氧化物,但氢氧化铝只溶于强碱,不溶于弱碱;生石灰具有吸水性,能吸收系统中的水蒸气,硫酸铜溶液中析出胆矾晶体。
试题分析:I中CCl4密度比水大,下层呈紫红色,A错误;氨气通入氯化铝溶液生成白色沉淀,氨气过量,沉淀不溶解,B错误;氯化铁溶液与硫氰化钾溶液生成血红色溶液,C错误。
考点:化学实验
点评:氢氧化铝是两性氢氧化物,但氢氧化铝只溶于强碱,不溶于弱碱;生石灰具有吸水性,能吸收系统中的水蒸气,硫酸铜溶液中析出胆矾晶体。

练习册系列答案
相关题目
下列实验操作或对实验事实的叙述正确的是______(填序号).
①用稀HNO3清洗做过银镜反应实验的试管
②用瓷坩埚高温熔融Fe(CrO2)2和Na2CO3的固体混合物
③读取滴定管内液体的体积,俯视读数导致读数偏小
④不慎将苯酚溶液沾到皮肤上,立即用酒精清洗
⑤向盛有沸水的烧杯中滴加FeCl3饱和溶液并长时间煮沸,以制备Fe(OH)3胶体
⑥向2.0mL浓度均为0.1mol/L的KCl、KI混合溶液中滴加1~2滴0.01mol/L AgNO3
溶液,振荡,沉淀呈黄色
某课外小组对一些金属单质和化合物的性质进行研究.
(1)下表为“铝与氯化铜溶液反应”实验报告的一部分:
| 实验步骤 | 实验现象 |
| 将打磨过的铝片(过量)放入一定浓度的CuCl2溶液中 | 产生气泡,析出疏松的红色固体,溶液逐渐变为无色 |
反应结束后分离出溶液备用 | |
| 红色固体用蒸馏水洗涤后,置于潮湿空气中 | 一段时间后固体由红色变为绿色[其主要成分为Cu2(OH)2CO3] |
①按反应类型写出实验中发生反应的化学方程式各一个(是离子反应的只写离子方程式):
置换反应______
化合反应______.
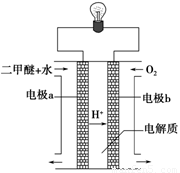
②用石墨作电极,电解上述实验分离出的溶液,两极产生气泡.持续电解,在阴极附近的溶液中还可观察到的现象是______,解释此现象的离子方程式是______
(2)探究氧化铜性质
①取A、B两支试管,向A中先加入适量CuO粉末,再分别向A和B中加入等体积的3% H2O2溶液,只观察到A中有大量气泡.实验结论是______.
②用收集气体并测定其体积的方法探究试管A中反应的速率,必需的实验仪器有:______.
 已知2NO2(g)?N2O4(g)△H(298K)=-52.7kJ?mol-1,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验:
已知2NO2(g)?N2O4(g)△H(298K)=-52.7kJ?mol-1,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验:

 CH3OH(g),CO的平衡转化率与温度、压强的关系如下图所示,则:
CH3OH(g),CO的平衡转化率与温度、压强的关系如下图所示,则:



 CH3OH(g),CO的平衡转化率与温度、压强的关系如下图所示,则:
CH3OH(g),CO的平衡转化率与温度、压强的关系如下图所示,则:

