题目内容
【题目】下列图示与对应的叙述相符的是
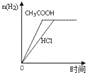

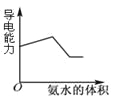
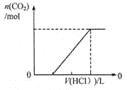
图1 图2 图3 图4
A.图1表示向等体积、等物质的量浓度的盐酸和醋酸溶液中,分别加入足量镁粉
B.图2表示向Ba(OH)2、KAlO2混合溶液中通入CO2
C.图3表示表示向盐酸和醋酸混合溶液中滴入氨水
D.图4表示在含等物质的量NaHCO3、Na2CO3的混合溶液中滴加0.1mol·L-1盐酸至过量时,产生气体的体积与消耗盐酸的关系
【答案】D
【解析】
A、醋酸是弱酸,存在电离平衡,因此向等体积、等物质的量浓度的盐酸和醋酸溶液中,分别加入足量镁粉产生的氢气体积相等,但盐酸反应速率比醋酸的反应速率快,A不正确;
B、向Ba(OH)2、KAlO2混合溶液中通入CO2,发生的反应分别是Ba(OH)2+CO2=BaCO3↓+H2O、2KAlO2+CO2+3H2O=2Al(OH)3↓+K2CO3、K2CO3+CO2+H2O=2KHCO3、BaCO3+CO2+H2O=Ba(HCO3)2,因此图2不能表示其反应过程,B不正确;
C、向盐酸和醋酸混合溶液中滴入氨水分别生成氯化铵、醋酸铵,溶液的导电性增强。当恰好反应后,溶液的导电性几乎不再发生变化,因此图3不能表示溶液的导电变化过程,C不正确;
D、碳酸钠与盐酸反应是分步进行的,因此向含等物质的量NaHCO3、Na2CO3的混合溶液中滴加0.1mol·L-1盐酸至过量时,发生反应的方程式分别为CO32-+H+=HCO3-、HCO3-+H+=H2O+CO2↑,因此产生气体的体积与消耗盐酸的关系可以用图4表示,D正确;
答案选D。

 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案【题目】下列离子组在给定条件下离子共存判断及反应的离子方程式均正确的是( )
选项 | 条件 | 离子组 | 离子共存判断及反应的离子方程式 |
A | 滴加氨水 | Na+、Al3+、Cl-、NO3- | 不能大量共存,Al3++3OH-=Al(OH)3↓ |
B | AG=lg[ | NH4+、Fe2+、I﹣、NO3- | 一定能大量共存 |
C | pH=1的溶液 | Fe2+、Al3+、 SO42-、MnO4- | 不能大量共存,5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O |
D | 通入少量SO2气体 | K+、Na+、ClO-、SO42- | 不能大量共存,2ClO-+SO2+H2O=2HClO+SO32- |
A.AB.BC.CD.D
【题目】近年来,中国华北华中地区发生了严重的雾霾天气。汽车尾气、燃煤废气、冬季取暖排放的CO2等都是雾霾形成的原因。
(1)汽车尾气中排放的NOx和CO污染环境,在汽车尾气系统中装置催化转化器,可有效降低NOx和CO的排放。已知:① 2CO(g)+O2(g) ![]() 2CO2(g) ΔH=566.0 kJ/mol,② N2(g)+O2(g)
2CO2(g) ΔH=566.0 kJ/mol,② N2(g)+O2(g)![]() 2NO(g) ΔH=+180.5 kJ/mol,③ 2NO(g)+O2(g)
2NO(g) ΔH=+180.5 kJ/mol,③ 2NO(g)+O2(g) ![]() 2NO2(g) ΔH=116.5 kJ/mol。 回答下列问题:
2NO2(g) ΔH=116.5 kJ/mol。 回答下列问题:
CO的燃烧热为________。CO将NO2还原为单质的热化学方程式为______________。
(2)改变煤的利用方式可减少环境污染,通常可将煤气化转化为水煤气,其反应原理为:C(s)+H2O(g) ![]() CO(g)+H2(g) ; △H=+131.3kJ/mol。
CO(g)+H2(g) ; △H=+131.3kJ/mol。
①该反应在_________下能自发进行(填“高温”或“低温”)。
②水煤气燃烧过程中产生的CO2气体可以与“84消毒液”的主要成分NaClO发生反应,该反应的离子方程式为:___________________________________________________。(已知:酸性HCO3-<HClO<H2CO3)
(3)已知反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g),现将不同量的CO(g)和H2O(g)分别通人到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
CO2(g)+H2(g),现将不同量的CO(g)和H2O(g)分别通人到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
实验 | 温度/℃ | 起始量/mol | 平衡量/mol | 达平衡所需时间/min | |
CO | H2O | H2 | |||
1 | 650 | 4 | 2 | 1.6 | 6 |
2 | 900 | 2 | 1 | 0.4 | 3 |
3 | 900 | a | b | c | t |
①实验1条件下平衡常数K=________________(保留小数点后二位)。
②实验3中,若平衡时,CO的转化率大于水蒸气,则a、b必须满足的关系是______。
③该反应的△H ____0(填填“小于”,“大于”)。