题目内容
【题目】常温下,溶液M中存在的离子有A2- HA- H+ OH-等,存在的分子有H2O 、H2A 。根据题意回答下列问题:
(1)写出酸H2A的电离方程式:__________________________________________
(2)若溶液M由10mL 2mol.L-1NaHA溶液与10mL 2mol.L-1NaOH溶液混合而得,则溶液M中离子浓度由大到小的顺序为_____________________。已知常温下,Ksp(BaA)=1.8×10-10,向该混合溶液中加入10mL 1mol.L-1BaCl2溶液,混合后溶液中的C(Ba2+)为__________mol.L-1。
(3)若NaHA溶液呈碱性,则溶液M有下列三种情况:①0.01 mol.L-1的H2A溶液;②0.01 mol.L-1的NaHA溶液;③0.02 mol.L-1的HCl溶液与0.04 mol.L-1的NaHA溶液等体积混合而成。则三种情况的溶液中C(H2A)最大的为__________(填序号,下同);pH由大到小的顺序为_______
【答案】![]() 、
、![]()
![]()
![]() ③ ②>③>①
③ ②>③>①
【解析】
(1)存在的分子有H2O、H2A,则H2A为弱酸;
(2)当NaHA与NaOH等物质的量反应后生成Na2A,共0.02mol,由于A2-水解使得溶液显碱性,pH>7,根据溶液呈碱性判断离子浓度;由反应式Ba2++A2-=BaA↓可得:沉淀后A2-过量0.01mol,溶液中c(A2-)=1/3molL-1,根据BaA的Ksp=c(Ba2+)c(A2-)可得c(Ba2+);
(3)①弱酸电离,②中水解生成分子,③中等体积混合后为等量的NaCl、NaHA、H2A,抑制弱酸的电离。
(1)存在的分子有H2O、H2A,则H2A为弱酸,电离方程式为 ![]() 、
、![]() ,故答案为:
,故答案为:![]() 、
、![]() ;
;
(2)当NaHA与NaOH等物质的量反应后生成Na2A,共0.02mol,由于A2-水解使得溶液显碱性,pH>7,可得溶液中离子浓度的大小顺序为c(Na+)>c(A2-)>c(OH-)>c(HA-)>c(H+);由反应式Ba2++A2-=BaA↓可得:沉淀后A2-过量0.01mol,溶液中c(A2-)=1/3molL-1,根据BaA的Ksp=c(Ba2+)c(A2-)可得c(Ba2+)=Ksp/c(A2-)=![]() molL-1,故答案为:c(Na+)>c(A2-)>c(OH-)>c(HA-)>c(H+);
molL-1,故答案为:c(Na+)>c(A2-)>c(OH-)>c(HA-)>c(H+);![]() ;
;
(3)①弱酸电离,②中水解生成分子,③中等体积混合为等量的NaCl、NaHA、H2A,抑制弱酸的电离,则三种情况的溶液中H2A分子浓度最大的为③,最小的为②,②中水解显碱性,①③相比①的酸性强,则pH最小,所以②>③>①,故答案为:③;②>③>①。

【题目】研究氮及其化合物的性质在人类进步过程中具有极为重要的意义。
(1)肼(N2H4)与N2O4分别是火箭发射中最常用的燃料与氧化剂。已知2N2H4(l)+N2O4(l)===3N2(g)+4H2O(l) ΔH=-1 225 kJ·mol-1。几种化学键的键能数据如下:
化学键 | N—H | N—N | N≡N | O—H |
键能/(kJ·mol-1) | 390 | 190 | 946 | 460 |
则1 mol N2O4(l)完全分解成相应的原子时需要吸收的能量是________。
(2)N2O4与NO2转化的热化学方程式为N2O4(g)![]() 2NO2(g) ΔH=+24.4 kJ·mol-1。
2NO2(g) ΔH=+24.4 kJ·mol-1。
①将一定量的N2O4投入固定容积的真空容器中,下述现象能说明反应达到平衡的是________(填字母)。
a.v正(N2O4)=2v逆(NO2) b.体系颜色不变
c.气体平均相对分子质量不变 d.气体密度不变
②在一密闭容器中发生该反应,达到平衡后,保持体积不变升高温度,再次达到平衡时,则混合气体的颜色________(填“变深”“变浅”或“不变”),判断理由______________________________________。
③平衡常数K可用反应体系中气体物质平衡分压表示,即K表达式中平衡浓度可用平衡分压代替,分压=总压×物质的量分数[例如:p(NO2)=p总×x(NO2)]。写出上述反应平衡常数K的表达式________(用p总、各气体物质的量分数x表示);影响K的因素为________。
(3)氨是一种重要的化工原料,在工农业生产中有广泛的应用。在773 K时,分别将2.00 mol N2和6.00 mol H2充入一个固定容积为1 L的密闭容器中,限着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间(t)的关系如表所示:
t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
n(H2/span>)/mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
n(NH3)/mol | 0 | 1.00 | 1.60 | 1.80 | 1.98 | 2.00 | 2.00 |
①该温度下,若向同容积的另一容器中投入N2、H2、NH3,其浓度均为3 mol·L-1,则此时v正________________(填“大于”“小于”或“等于”)。
②由表中的实验数据可得到“c—t”的关系,如图1所示,表示c(N2)—t的曲线是________。在此温度下,若起始充入4 mol N2和12 mol H2,则反应刚达到平衡时,表示c(H2)—t的曲线上相应的点为________。
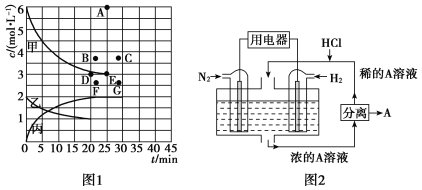
(4)有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图2所示。电池正极的电极反应式是____________________,A是_______________________________。