题目内容
已知下列热化学方程式:
C(s)+O2(g)![]() CO2(g) ΔH=-393.5 kJ·mol-1
CO2(g) ΔH=-393.5 kJ·mol-1
CO(g)+1/2O2(g)![]() CO2(g) ΔH=-283.0 kJ·mol-1
CO2(g) ΔH=-283.0 kJ·mol-1
计算1 mol固态碳粉燃烧生成CO(g)放出的热量,并写出相应的热化学方程式.
答案:
解析:
解析:
|
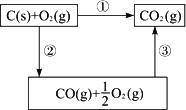
答案:110.5 kJ C(s)+ 解析:本题要求的是1 mol固态碳粉生成CO(g)时放出的热量及相应的化学方程式,即C(s)+1/2O2(g) 据题示信息可将两个已知的热化学方程式和待求的热化学方程式组成如下关联框图:
其中①③式对应的热化学方程式已给出,将①③两个热化学方程式相减,即得②对应的热化学方程式. 由此即可求出1 mol C(s)燃烧生成CO(g)时放出热量为110.5 kJ. |

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 煤炭可以转化为清洁能源和化工原料.
煤炭可以转化为清洁能源和化工原料.