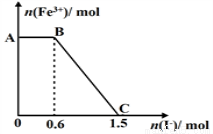
题目内容
下列离子方程式正确的是
A.Fe和稀硫酸反应:2Fe+6H+== 2Fe3++3H2↑
B.Na2O2溶于水产生O2:Na2O2+H2O == 2Na++2OH–+O2↑
C.用石墨做电极电解饱和MgCl2溶液:2Cl–+2H2O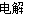 Cl2↑+H2↑+2OH–
Cl2↑+H2↑+2OH–
D.强碱溶液中NaClO与Fe(OH)3反应生成Na2FeO4:4OH–+3ClO–+2Fe (OH)3 == 2FeO42–+3Cl–+5H2O
D
【解析】
试题分析:A.铁与稀硫酸反应生成Fe2+,A错误;B.离子方程式是必须符合质量守恒定律和电荷守恒定律,应为2Na2O2+2H2O == 4Na++4OH–+O2↑,B错误;C. 用石墨做电极电解饱和MgCl2溶液:Mg2++2Cl–+2H2O==== Cl2↑+H2↑+Mg(OH)2↓,C错误;D正确;选D。
考点:考查离子方程式的正误判断。

练习册系列答案
相关题目
下列有关化学用语表示不正确的是
A.氧的原子结构示意图: |
B.Na2O2的电子式: |
| C.HClO的结构式:H—O—Cl |
D.中子数为16的硫离子: S2- S2- |
下列溶液中Cl-的物质的量浓度最大的是
| A.200 mL 2 mol·L-1 MgCl2溶液 |
| B.1000 mL 2.5mol·L-1NaCl溶液 |
| C.250 mL 1 mol·L-1 AlCl3溶液 |
| D.300 mL 5 mol·L-1 KClO3溶液 |
下列叙述正确的是( )
| A.1 mol H2O的质量为18 g/mol |
| B.CH4的摩尔质量为16 g |
| C.3.01×1023个SO2分子的质量为32 g |
| D.2 mol NaOH溶于1 L水中配成溶液的浓度为2 mol·L―1 |