题目内容
10.NA表示阿伏加德罗常数.下列说法中正确的是( )| A. | 标准状况下,22.4LNO和11.2LO2混合后气体的分子总数为1.5NA | |
| B. | 6.2gNa2O和7.8gNa2O2混合物中所含有的阴离子数为0.3 NA | |
| C. | 14g乙烯和丙烯的混合物中,含有共用电子对数目为3×6.02×1023 | |
| D. | 18g D2O(重水)完全电解,转移6.02×1023个电子 |
分析 A、由2NO+O2═2NO2,2NO2?N2O4,利用气体的物质的量来分析分子总数;
B、分别求出Na2O和Na2O2的物质的量,然后根据Na2O和Na2O2均由2个阳离子和1个阴离子构成来分析;
C、乙烯和丙烯的最简式均为CH2;
D、D2O的摩尔质量为20g/mol,先求出重水的物质的量,然后根据1mol重水电解时转移2mol电子来分析.
解答 解:A、标准状况下,22.4LNO和11.2L氧气的物质的量分别为1mol、0.5mol,由2NO+O2═2NO2,2NO2?N2O4,则气体的分子总数小于NA个,故A错误;
B、6.2gNa2O的物质的量n=$\frac{6.2g}{62g/mol}$=0.1mol,7.8gNa2O2的物质的量n=$\frac{7.8g}{78g/mol}$=0.1mol,而Na2O和Na2O2均由2个阳离子和1个阴离子构成,故0.1molNa2O和0.1mol
Na2O2中均含0.1mol阴离子,则混合物中共含0.2mol阴离子,为0.2NA个,故B错误;
C、乙烯和丙烯的最简式均为CH2,故14g混合物中含有的CH2的物质的量n=$\frac{14g}{14g/mol}$=1mol,故含3mol共用电子对,即3NA个,故C正确;
D、D2O的摩尔质量为20g/mol,故18g重水的物质的量n=$\frac{18g}{20g/mol}$=0.9mol,而1mol重水电解时转移2mol电子,则0.9mol重水转移1.8mol电子,即1.8NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.如图为元素周期表短周期中的一部分,有关元素X、Y、Z、M的说法不正确的是( )
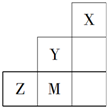

| A. | Y单质的氧化性比M单质的氧化性强 | |
| B. | X原子最外层可达到8电子的稳定结构 | |
| C. | 原子半径:Z>M>Y | |
| D. | M的气态氢化物的稳定性强于Z |
1.碳元素有的三种原子:${\;}_{6}^{12}$C、${\;}_{6}^{13}$C、${\;}_{6}^{14}$C,下列各项对三种原子均不同的是( )
| A. | 元素种类 | B. | 核电荷数 | C. | 电子层数 | D. | 中子数 |
15.下列说法正确的是( )
| A. | 有一种第五形态的固体碳,这种新的碳结构称作“纳米泡沫”,它外形类似海绵,比重极小,并具有磁性.纳米泡沫碳与金刚石的转化是化学变化 | |
| B. | NO2能与水反应生成硝酸,所以NO2是酸性氧化物 | |
| C. | 铝粉和氧化镁粉末可以组成铝热剂发生铝热反应 | |
| D. | 某元素的气态氢化物能与其最高价氧化物对应的水化物发生化学反应,则该元素一定是N元素 |
19.下列说法正确的是( )
| A. | 含4molHCl的浓盐酸与足量MnO2充分反应,转移2NA个电子 | |
| B. | 500℃、30MPa下,将0.2mol N2和0.6molH2置于密闭的容器中充分反应生成NH3(g),放热7.72kJ,其热化学方程式为: N2(g)+3H2(g) $?_{500℃、30MPa}^{催化剂}$ 2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | 对于可逆反应N2(g)+3H2(g)$?_{高温高压}^{催化剂}$2NH3(g),△H<O;升高温度,可使反应速率增大,反应逆向移动 | |
| D. | 元素原子的最外层电子数的多少与其非金属性的强弱无必然联系 |
19.放射性同位素14C可用来推算文物的“年龄”.14C的含量每减少一半要经过约5730年.某考古小组挖掘到一块动物骨骼,经测定14C还剩余$\frac{1}{8}$,推测该动物生存年代距今约为( )
| A. | 5730×3年 | B. | 5730×4年 | C. | 5730×6年 | D. | 5730×8年 |

 如表为元素周期表短周期的一部分.回答下列问题:
如表为元素周期表短周期的一部分.回答下列问题: