题目内容
下列反应中,有黑色物质生成的是
[ ]
A.蔗糖和稀硫酸
B.镁在二氧化碳中燃烧
C.三氯化铁溶液和氢氧化钾溶液混合
D.硫粉和铁粉共热
答案:BD

练习册系列答案
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
 铁盐、亚铁盐在工农业生产、生活、污水处理等方面有着极其广泛的应用.
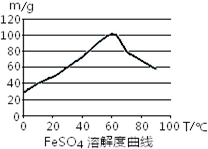
铁盐、亚铁盐在工农业生产、生活、污水处理等方面有着极其广泛的应用.(1)用铁屑与稀硫酸反应制备FeSO4
①制备原理用离子方程式表示为
FeSO4生成速率,采取下列措施中正确的是
A.使用浓硫酸与铁屑反应
B.使用磨细的铁粉反应
C.控制温度在50~70℃
D.控制温度在80~100℃
②在上述反应过程中,常会伴随发生反应:4Fe2++O2+4H+?4Fe3++2H2O
若要减少产品FeSO4中Fe3+的含量,采取下列措施中正确的是
A.控制稀硫酸的浓度不能太高
B.用去O2蒸馏水注入浓硫酸配制反应所需的稀硫酸
C.反应中保持n(Fe)/n(H2SO4)>1
D.反应中应经常添加Fe2(SO4)3搅拌
③反应结束后,将溶液进行
(2)工业上用含有少量Cu、Al的废铁屑制备Fe2(SO4)3
其反应及操作流程如下:
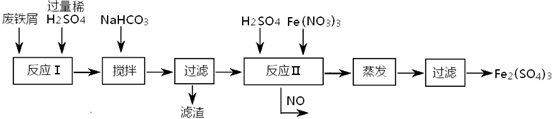
①加入NaHCO3并搅拌,将混合液pH调控至
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Cu(OH)2 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 | 4.7 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 | 6.7 |
③生产中,将反应Ⅱ产生的NO配比一种气体X,混合后重新通入反应Ⅱ中,该设计的目的是
(3)用Fe2(SO4)3处理含S2-污水时,有黑色沉淀及淡黄色悬浮物产生,其反应的离子方程式是

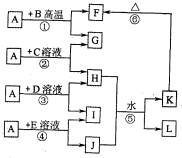 如图所示,A、G、I均为单质,其中A、G为金属且都常被用作输电线,且G单质有特殊颜色,B为黑色粉末,L是由两种元素组成的盐,它是家庭厨房必备物品.请回答:
如图所示,A、G、I均为单质,其中A、G为金属且都常被用作输电线,且G单质有特殊颜色,B为黑色粉末,L是由两种元素组成的盐,它是家庭厨房必备物品.请回答:
 (2010?江苏一模)过渡元素在生活、生产和科技等方面有广泛的用途.
(2010?江苏一模)过渡元素在生活、生产和科技等方面有广泛的用途.
