题目内容
【题目】完成下列填空:
(1)下图是N2(g)和H2(g)反应生成1mol NH3(g)过程中能量变化示意图,写出N2和H2反应的热化学方程式:____________________.

(2)若已知下列数据:试根据表中及图中数据计算N-H的键能____________kJ·mol-1.
化学键 | H-H | N≡N |
键能/kJ·mol-1 | 435 | 943 |
(3)合成氨反应通常用铁触媒作催化剂。使用铁触媒后E1和E2的变化是:E1___________,E2 _________ (填“增大”、“减小、”“不变”)。
(4)用NH3催化还原NOX还可以消除氮氧化物的污染。例如4NH3(g)+3O2(g)=2N2(g)+6H2O(g);ΔH1= a kJ·mol-1N2(g)+O2(g)=2NO(g);ΔH2=b kJ/mol若1mol NH3还原NO至N2,写出该反应的热化学方程式__________(ΔH用a、b表示).
【答案】N2(g) + 3 H2(g) ![]() 2NH3(g) ΔH=-92kJ·mol-1 390 减小 减小 NH3(g) +
2NH3(g) ΔH=-92kJ·mol-1 390 减小 减小 NH3(g) + ![]() NO(g) =
NO(g) = ![]() N2(g) +
N2(g) +![]() H2O(g),ΔH =
H2O(g),ΔH = ![]()
【解析】
⑴根据图像得出生成1mol气态氨气放出的热量,再写出热化学方程式。
⑵根据焓变等于断键吸收的热量减去成键放出的热量进行计算。
⑶使用催化剂会降低反应所需活化能。
⑷根据盖斯定律进行计算。
⑴根据图像可知生成1mol NH3(g)放出了46kJ的热量,因此N2(g)和H2(g)反应生成NH3(g)的热化学方程式为:N2(g) + 3 H2(g) ![]() 2NH3(g) ΔH=-92kJ·mol-1,故答案为:N2(g) + 3 H2(g)
2NH3(g) ΔH=-92kJ·mol-1,故答案为:N2(g) + 3 H2(g) ![]() 2NH3(g) ΔH=-92kJ·mol-1。
2NH3(g) ΔH=-92kJ·mol-1。
⑵设N—H的键能为x kJ·mol-1.,ΔH = 943 + 435×3-6x =-92,x = 390,故答案为390。
⑶使用铁触媒催化剂,活化能降低,因此E1减小,E2减小;故答案为:减小;减小。
⑷4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ΔH1= a kJ·mol-1 N2(g)+O2(g)=2NO(g) ΔH2=b kJ/mol将第1个方程减去第2个方程的3倍得到, NH3(g) + ![]() NO(g) =
NO(g) = ![]() N2(g) +
N2(g) +![]() H2O(g),ΔH =
H2O(g),ΔH = ![]() ,故答案为:NH3(g) +
,故答案为:NH3(g) + ![]() NO(g) =
NO(g) = ![]() N2(g) +
N2(g) +![]() H2O(g),ΔH =
H2O(g),ΔH = ![]() 。
。

【题目】I、下图为汽车尾气处理系统中“三元催化”的工作原理,NO和CO在催化剂作用下生成无污染性物质的方程式2NO+2CO![]() N2+2CO2。
N2+2CO2。
某课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验。
实验编号 | 实验目的 | T/℃ | NO初始浓度/mol·L-1 | CO初始浓度/mol·L-1 | 同种催化剂的比表面积/m2·g-1 | c(CO)不变时所用的时间/min |
① | 参照 | 280 | 6.50×10-3 | 4.00×10-3 | 80 | t |
② | 280 | 6.50×10-3 | 4.00×10-3 | 120 | 0.5t | |
③ | 360 | 6.50×10-3 | 4.00×10-3 | 80 | 0.2t |
(1)实验编号②的实验目的为_______。
(2)课题中探究外界条件对汽车尾气转化反应速率的影响的另一因素是________。
II、某温度下在4 L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图。
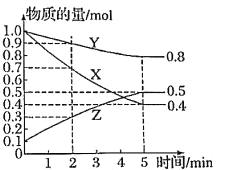
(1)该反应的化学方程式是______。
(2)该反应达到平衡状态的标志是
A. Y的体积分数在混合气体中保持不变
B. X、Y的反应速率比为3:1
C. 容器内气体压强保持不变
D. 容器内气体的总质量保持不变
E. 生成1 mol Y的同时消耗2 mol Z
(3)2~5min内用X表示的化学反应速率为_____。
【题目】元素周期表是学习化学的重要工具,它隐含着许多信息和规律。
I.请根据下表中短周期元素的原子半径和主要化合价,回答表后问题。
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
原子半径(10-10 m) | 0.74 | 1.60 | 0.53 | 1.10 | 0.99 | 1.11 | 0.75 | 1.43 |
最高或最低化合价 | +2 | +1 | +5 | +7 | +2 | +5 | +3 | |
-2 | -3 | -1 | -3 |
(1)元素①在周期表中的位置为________。
(2)元素①、⑦的氢化物的稳定性由强到弱的顺序为_________(填化学式);
(3)元素①、③形成的18电子化合物的电子式为______;
(4)元素②、⑧的最高价氧化物对应的水化物中,碱性较强的是______(填化学式);
(5)元素⑤、⑧的最高价氧化物对应的水化物的水溶液反应的离子方程式为_________。
II.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格。
(6)铅蓄电池在放电时发生的电池反应式为:Pb+PbO2+2H2SO4===2PbSO4+2H2O。铅蓄电池放电时正极是__(填物质化学式)。若电解液体积为2L(
(7)甲醛(HCHO)燃料电池的工作原理如下图所示。

①该电池工作时,b口通入的物质为________;
②该电池工作时,电子的流向为___________(填“从左到右”或“从右到左”);
③右侧电极的电极反应方程式为___________。
【题目】下列我国科技创新的产品设备在工作时,能量转化过程与氧化还原反应有关的是( )
|
|
|
|
①长征三号运载火箭用偏二甲肼为燃料 | ②嫦娥四号月球探测器上的太阳能电池板 | ③和谐号动车以350 km/h飞驰 | ④世界首部可折叠柔屏手机通话 |
A.①②B.③④C.②③D.①④