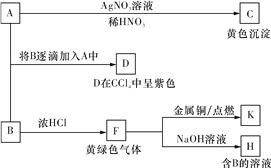
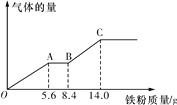
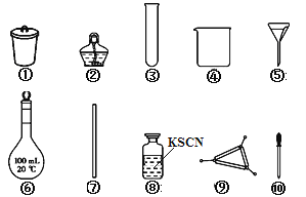
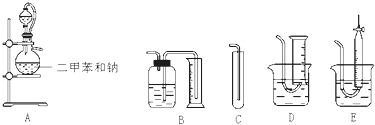
题目内容
【题目】下列说法正确的是( )
A.pH=2和pH=1的硝酸中c(H+)之比为10:1
B.一元酸与一元碱恰好完全反应后的溶液中一定存在c(H+)=c(OH﹣)
C.KAl(SO4)2溶液中离子浓度的大小顺序为c(SO ![]() )>c(K+)>c(Al3+)>c(H+)>c(OH﹣)
)>c(K+)>c(Al3+)>c(H+)>c(OH﹣)
D.常温下,将pH均为12的氨水和NaOH溶液分别加水稀释100倍后,NaOH溶液的pH较大
【答案】C
【解析】解:A、pH=2的硝酸中c(H+)=10﹣pH=0.01mol/L,pH=1的硝酸中c(H+)=10﹣pH=0.1mol/L,故c(H+)之比为1:10,故A错误; B、一元酸与一元碱恰好完全反应生成的盐可能为强酸强碱盐、弱酸强碱盐或强酸弱碱盐或弱酸弱碱盐,故不一定显中性,故B错误;
C、KAl(SO4)2是强酸弱碱盐,SO42﹣浓度最大,由于SO4水解,故K+浓度大于SO4浓度,而溶液显酸性,故H+浓度大于OH﹣浓度,故正确的浓度顺序为:c(SO42﹣)>c(K+)>c(Al3+)>c(H+)>c(OH﹣),故C正确;
D、氨水为弱碱溶液,存在电离平衡,加水稀释时电离被促进,故OH﹣的浓度下降的比较慢;而氢氧化钠是强碱、不存在电离平衡,加水稀释时OH﹣下降的快,故稀释后的氢氧化钠的pH比氨水的小,故D错误.
故选C.

练习册系列答案
 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案
相关题目