题目内容
10.下列说法不正确的是( )石油$\stackrel{①}{→}$分馏产品$\stackrel{②}{→}$乙烯$\stackrel{③}{→}$1,2-二溴乙烷.
| A. | 石油经分馏可获得含碳原子少的轻质油 | |
| B. | ①主要发生物理变化 | |
| C. | ②是石油的裂化、裂解 | |
| D. | ③属于取代反应 |
分析 A.石油分馏可得到沸点不同的液化气、汽油、煤油、柴油等,提高轻质油的产量;
B.石油的分馏是根据各组分的沸点不同将石油蒸馏为各馏分的过程;
C.石油的裂解是一种更深度的裂化,二者都能够得到烯烃;
D.乙烯与溴加成生成1,2-二溴乙烷;
解答 解:A.石油分馏可获得含碳原子少的轻质油,如液化气、汽油等,故A正确;
B.石油的分馏是根据各组分的沸点不同将石油蒸馏为各馏分的物理过程,故B正确,
C.裂解是一种更深度的裂化,分馏产品通过裂化和裂解都可以制得乙烯,故C正确;
D.乙烯与溴的四氯化碳或溴水发生加成反应得到1,2-二溴乙烷,故D错误.
故选D.
点评 本题考查了石油的成分、石油的炼化过程等,属于基础知识的考查,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
20.下列物质中既有离子键又有共价键的是( )
| A. | NaCl | B. | H2O | C. | K2O | D. | NaOH |
1.在常温下,下列溶液呈酸性的是( )
| A. | NaCl溶液 | B. | NH4Cl溶液 | C. | Na2CO3溶液 | D. | CH3COONa溶液 |
15.下列离子在给定的条件下一定能大量共存的是( )
| A. | 加入Al粉放出H2的溶液中:Na+、K+、Fe3+、NO3- | |
| B. | 含有SCN-离子的溶液中:Ca2+、Fe2+、NO3-、Cl- | |
| C. | 水电离出的c(H+)=1×10-13mol/L的溶液中:Mg2+、K+、NO3-、Cl- | |
| D. | c(Fe3+)=0.1mol/L的溶液中:NH4+、Cl-、AlO2-、SO42- |
2.某有机物的结构简式如图所示.下列有关该物质的说法正确的是( )
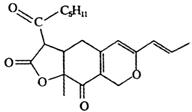

| A. | 该物质的分子式为C21H25O5 | |
| B. | 该物质含有四种含氧官能团 | |
| C. | 1 mol该物质在一定条件下最多可以和5mol H2反应 | |
| D. | 1 mol该物质最多能与2 mol NaOH反应 |
19.NA表示阿伏加德罗常数的值,下列说法不正确的是( )
| A. | 1mol12C原子的质量是12g,1个12C原子的质量是$\frac{12}{{N}_{A}}$g | |
| B. | 在常温常压下,11.2L N2含有分子数为0.5NA | |
| C. | 18 g水所含有的氢原子数目为2NA,氧原子数目为NA | |
| D. | 1L 0.1mol•L-1 Na2SO4溶液中,Na+和SO${\;}_{4}^{2-}$的离子总数是0.3NA |
9.水是最常用的溶剂,许多化学反应都需要在水溶液中进行.请仔细分析并回答下列各题.
(1)用0.1mol/LNaOH溶液滴定体积均为20.00mL、浓度均为0.1mol/L盐酸和醋酸溶液,得到如下所示滴定曲线图:
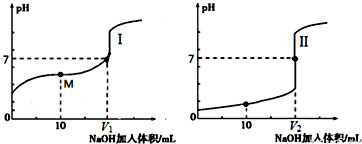
①用NaOH 溶液滴定醋酸溶液通常所选择的指示剂为酚酞,符合其滴定曲线的是I(填“I”或“II”);
②滴定前的上述三种溶液中,由水电离出的c(H+)最大的是CH3COOH溶液(填化学式);
③图中v1和v2大小的比较:v1<v2 (填“>”、“<”或“=”);
④图I中M 点对应的溶液中,各离子的浓度由大到小的顺序是c(CH3COO-)>c(Na+)>c(H+)>c(OH-).
(2)某同学为了研究难溶电解质的溶解平衡,设计了如下实验(相关数据测定温度及实验环境均为25℃):
查阅资料:AgSCN是白色沉淀:Ksp(AgSCN)=1.0×10-12;Ksp(AgI)=8.5×10-17.
①请结合化学用语和必要的文字解释步骤2 现象出现的原因:由于存在沉淀溶解平衡AgSCN(s)?Ag+(aq)+SCN-(aq),溶液中仍有少量SCN-,Fe3+与SCN-结合生成Fe(SCN)3从而显红色.
②该同学根据步骤3中现象a推知,加入的AgNO3与步骤2所得溶液发生了反应,则现象a为出现白色沉淀,溶液红色变浅.
③写出步骤4 中沉淀转化反应平衡常数的表达式:K=$\frac{c(SC{N}^{-})}{c({I}^{-})}$.
(1)用0.1mol/LNaOH溶液滴定体积均为20.00mL、浓度均为0.1mol/L盐酸和醋酸溶液,得到如下所示滴定曲线图:

①用NaOH 溶液滴定醋酸溶液通常所选择的指示剂为酚酞,符合其滴定曲线的是I(填“I”或“II”);
②滴定前的上述三种溶液中,由水电离出的c(H+)最大的是CH3COOH溶液(填化学式);
③图中v1和v2大小的比较:v1<v2 (填“>”、“<”或“=”);
④图I中M 点对应的溶液中,各离子的浓度由大到小的顺序是c(CH3COO-)>c(Na+)>c(H+)>c(OH-).
(2)某同学为了研究难溶电解质的溶解平衡,设计了如下实验(相关数据测定温度及实验环境均为25℃):
| 操作步骤 | 现象 |
| 步骤1:向20mL0.05mol/LAgNO3溶液中加入20mL0.05mol/LKSCN溶液,充分反应后过滤 | 出现白色沉淀 |
| 步骤2:向滤液中加少量2mol/LFe(NO3)3溶液 | 溶液变红色 |
| 步骤3:向步骤2所得溶液中,加入少量3mol/LAgNO3溶液 | 现象a |
| 步骤4:取步骤1所得少量滤渣加入到适量的3mol/LKI溶液中 | 出现黄色沉淀 |
①请结合化学用语和必要的文字解释步骤2 现象出现的原因:由于存在沉淀溶解平衡AgSCN(s)?Ag+(aq)+SCN-(aq),溶液中仍有少量SCN-,Fe3+与SCN-结合生成Fe(SCN)3从而显红色.
②该同学根据步骤3中现象a推知,加入的AgNO3与步骤2所得溶液发生了反应,则现象a为出现白色沉淀,溶液红色变浅.
③写出步骤4 中沉淀转化反应平衡常数的表达式:K=$\frac{c(SC{N}^{-})}{c({I}^{-})}$.